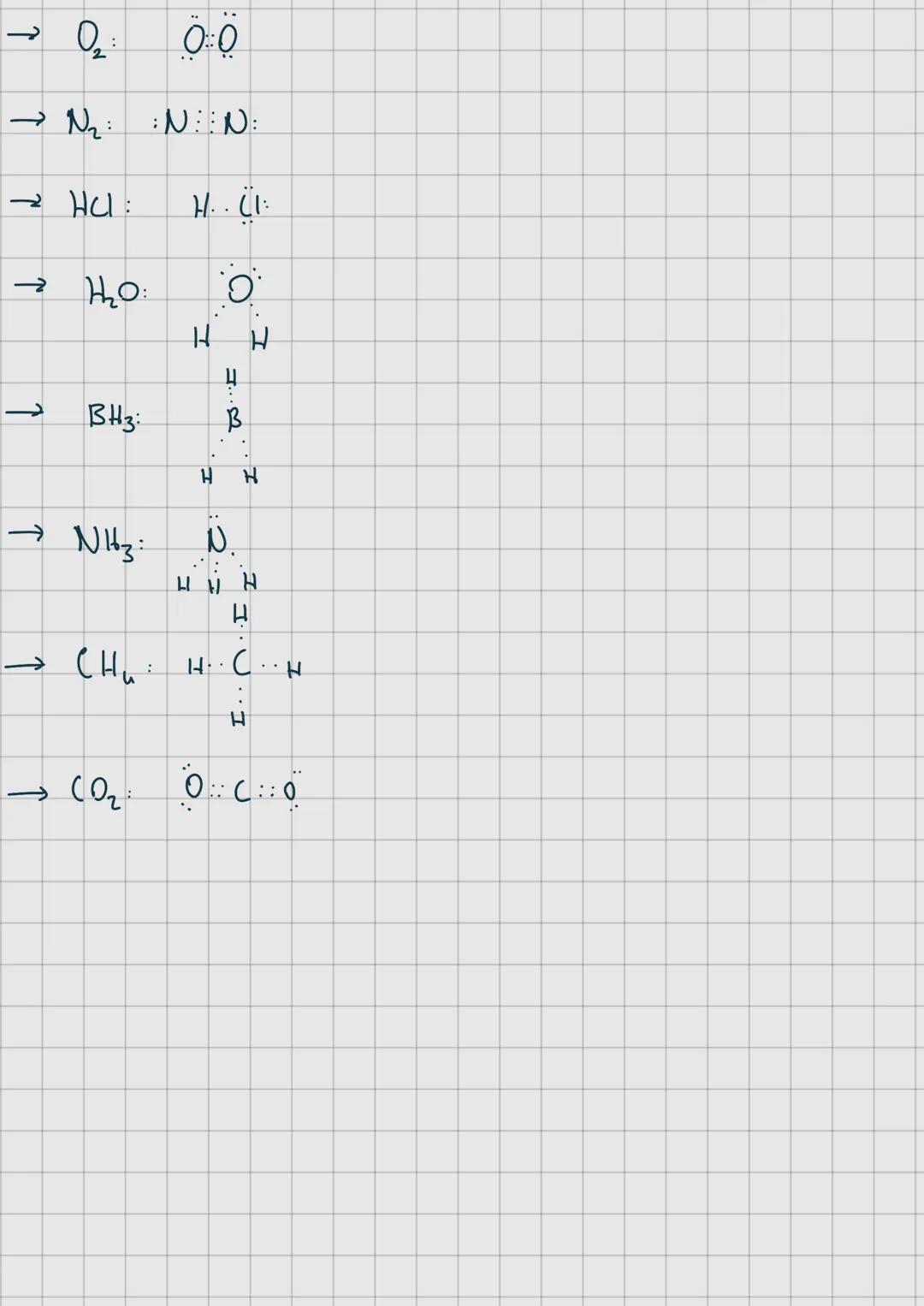Kovalent Bağın Temel Yapısı
Kovalent bağ, ametal atomları (H, C, N, O, F, Cl, Br, I, P, S, Se) arasında elektronların ortaklaşa kullanılmasıyla oluşur. Bu ortaklaşma sayesinde atomlar kararlı hale gelir ve molekülleri oluşturur.
Ortaklaşa kullanılan elektron çiftlerine bağlayıcı elektron çifti veya ortaklanmış elektron çifti adı verilir. Örneğin, H + H → H:H tepkimesinde, iki hidrojen atomu bir elektron çifti paylaşır. Bağ oluşumuna katılmayan elektronlar ise ortaklanmamış elektron çiftleri olarak adlandırılır.
Kovalent bağlar, molekül formüllerinde çizgi (-) ile gösterilir. Örneğin H-Cl bağında, elektronlar iki atom arasında paylaşılır. Kovalent bağlar temelde iki tipe ayrılır: Polar kovalent bağ ve apolar kovalent bağ.
⚠️ Dikkat: Polar kovalent bağda elektronlar eşit paylaşılmaz ve atomların birinde kısmi (+δ), diğerinde kısmi (-δ) yük oluşur. H-Cl bağında, elektronlar Cl tarafına daha fazla çekilir.
Polar kovalent bağ, farklı tür ametal atomları arasında oluşur (HCl, H₂O, BH₃, NH₃, CH₄, CO₂ gibi). Apolar kovalent bağ ise aynı tür ametal atomları arasında oluşur (H₂, N₂, O₂, Cl₂ gibi).