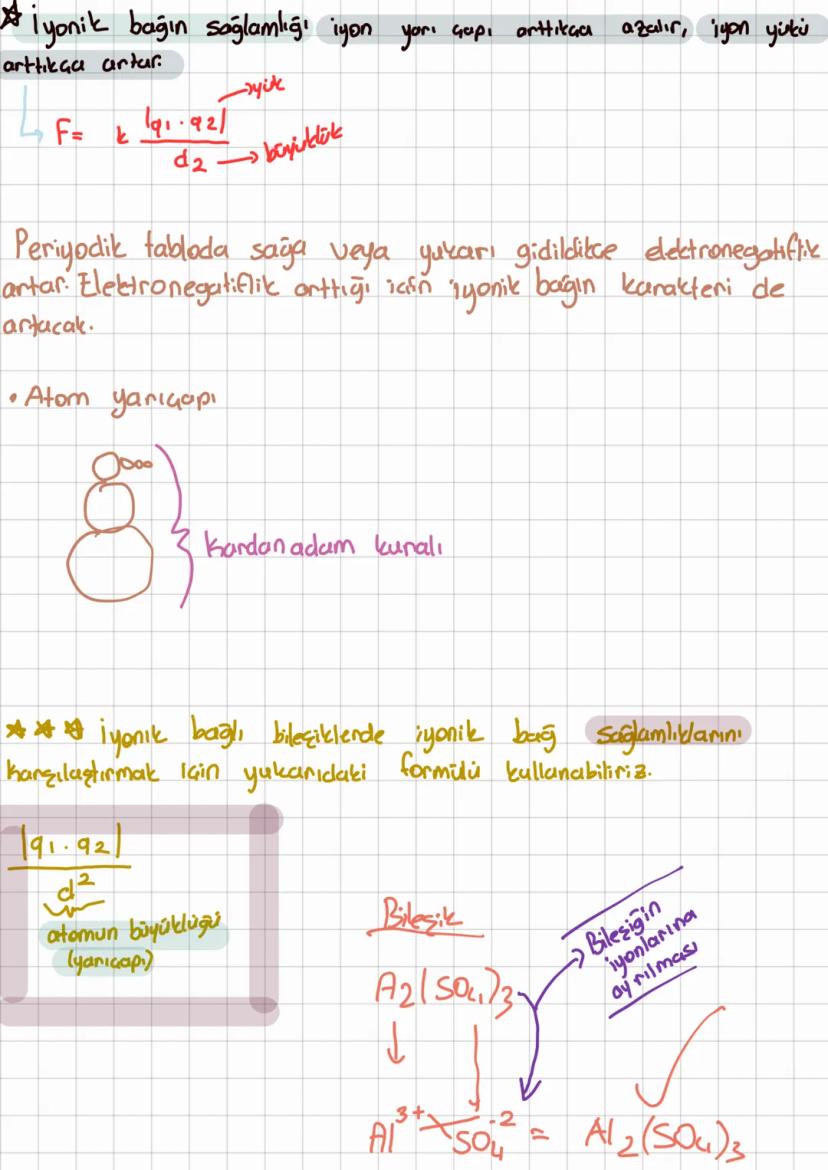
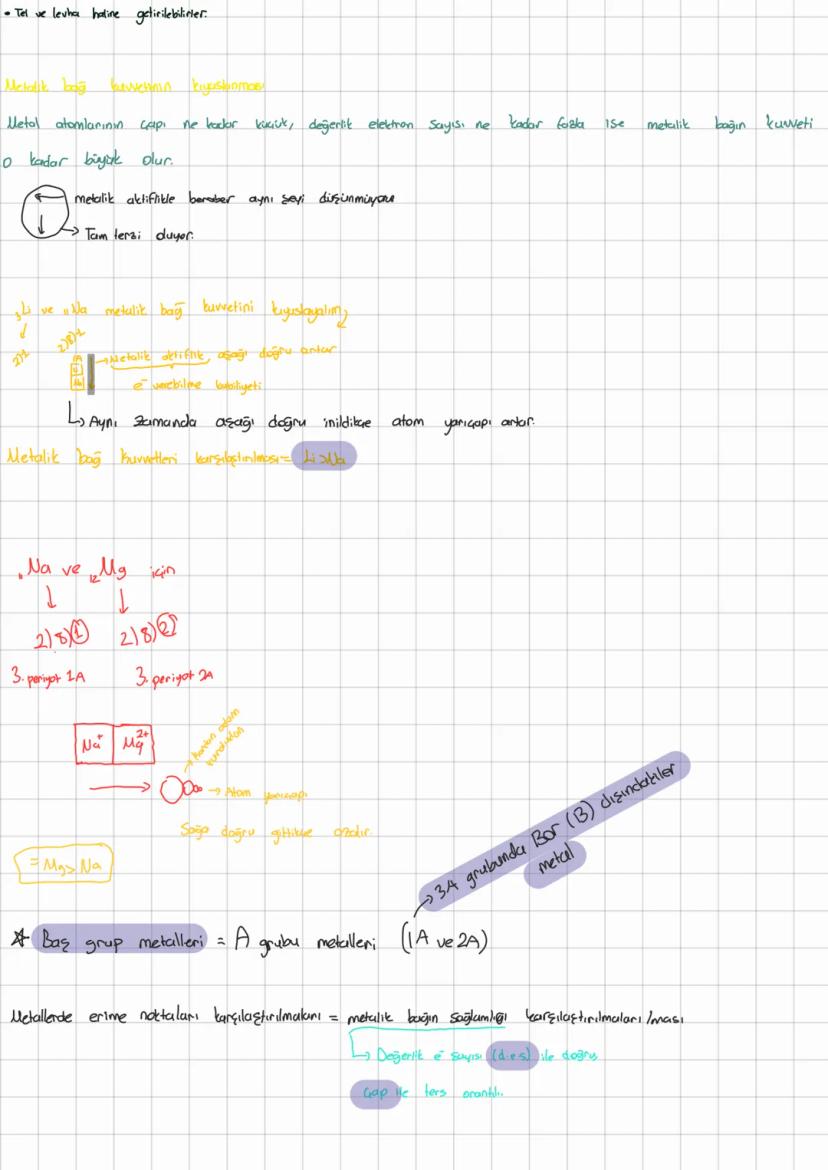
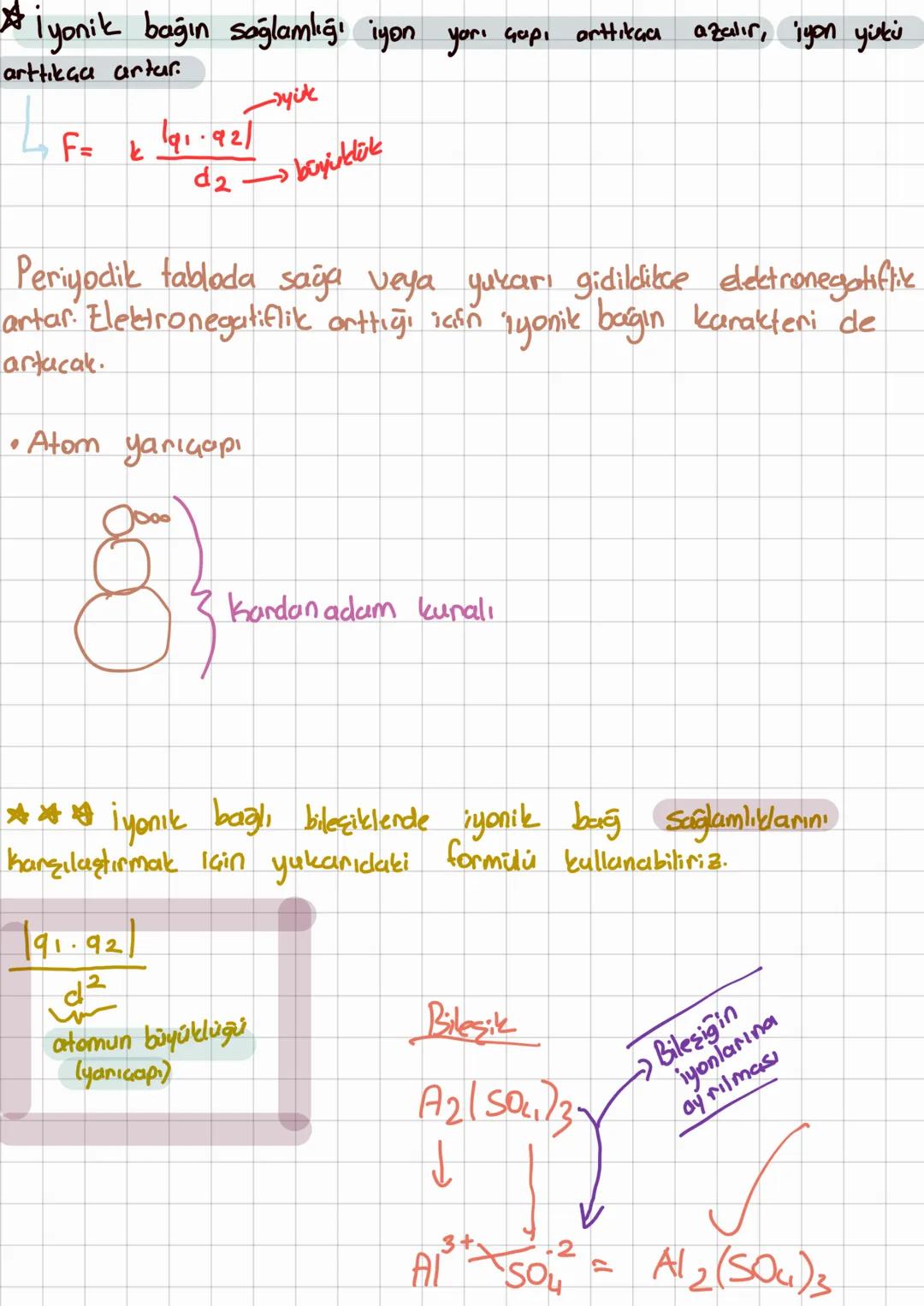
Kovalent Bağ
Kovalent bağ, ametal atomları arasında iki veya daha fazla elektronun ortaklaşa kullanılması ile oluşan bağlardır. HF, CH₄, Cl₂, CO₂, H₂ gibi bileşikler kovalent bağlıdır.
Ametaller elektronları ortaklaşa kullandığında, bunu çizgi şeklinde gösteririz H−Cl,H−Br,H−N. Lewis yapısında ortaklaşa kullanılan elektron çiftlerine "ortaklanmış (paylaşılmış) elektron çifti" denir. Bağ oluşumuna katılmayan elektron çiftlerine ise "ortaklanmamış (paylaşılmamış) elektron çifti" denir.
Lewis yapısını yazarken, her elementin değerlik elektronlarını nokta şeklinde gösteririz. Örneğin HCl bileşiğinde: H· + ·Cl: → H-Cl: şeklinde gösterilir. Klorun etrafında 6 nokta (3 çift) vardır.
Pratik İpucu: Hidrojen atomları kendilerini dublet yapıya (2 elektron) tamamlarken, diğer ametaller oktet yapıya (8 elektron) tamamlamaya çalışır.