Karışımlar ve Özellikleri
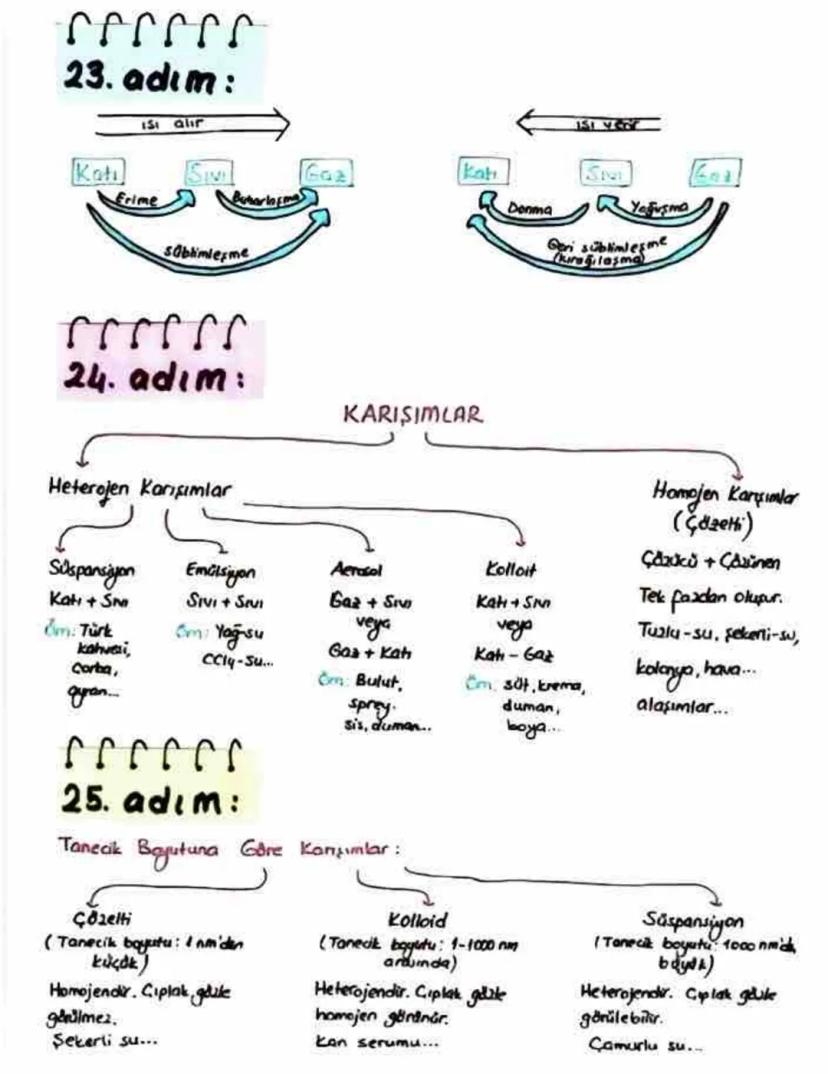
Karışımlar heterojen ve homojen olmak üzere ikiye ayrılır. Heterojen karışımlar farklı fazlardan oluşurken, homojen karışımlar (çözeltiler) tek fazdan oluşur.
Heterojen karışımların çeşitleri vardır: Süspansiyonlar katı+sıvı,o¨rn.Tu¨rkkahvesi, emülsiyonlar sıvı+sıvı,o¨rn.yag˘−su,CCl4−su, aerosoller gaz+sıvı/katı,o¨rn.bulut,duman,sis ve kolloitler katı+sıvı,o¨rn.su¨t,krema,boya. Bu karışımlarda farklı fazlar gözle veya mikroskopla görülebilir.
Homojen karışımlar (çözeltiler) ise çözücü ve çözünenden oluşur. Tuzlu su, şekerli su, kolonya, hava ve alaşımlar buna örnektir. Çözeltilerde tek bir faz vardır ve bileşenler gözle ayırt edilemez.
Örnek ver! Tanecik boyutuna göre karışımları günlük hayattan örneklerle hatırlayabilirsin: Şekerli su (çözelti), süt (kolloit) ve çamurlu su (süspansiyon).
Tanecik boyutuna göre karışımlar üç grupta incelenir: Çözeltiler (tanecik boyutu 1 nm'den küçük) homojendir ve çıplak gözle görülmez. Kolloitler tanecikboyutu1−1000nm aslında heterojendir ama homojen görünür. Süspansiyonlar (tanecik boyutu 1000 nm'den büyük) heterojendir ve çıplak gözle görülebilir.