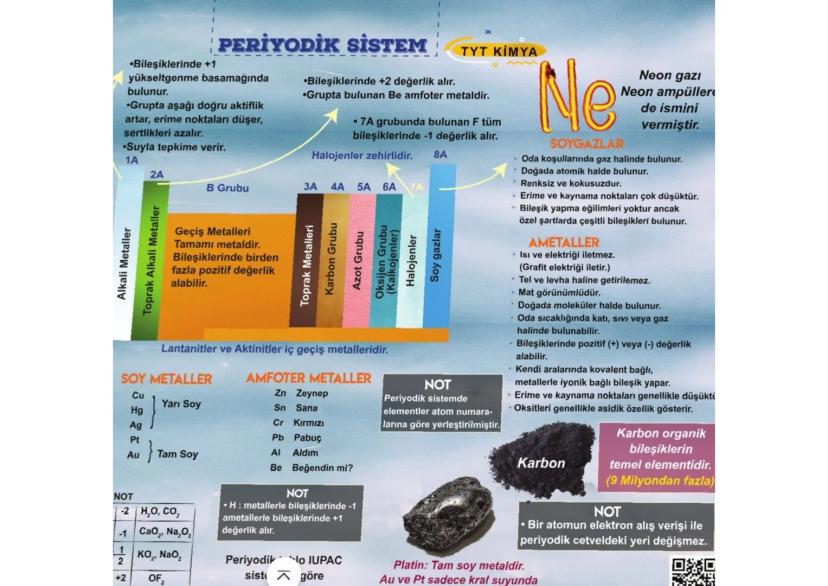
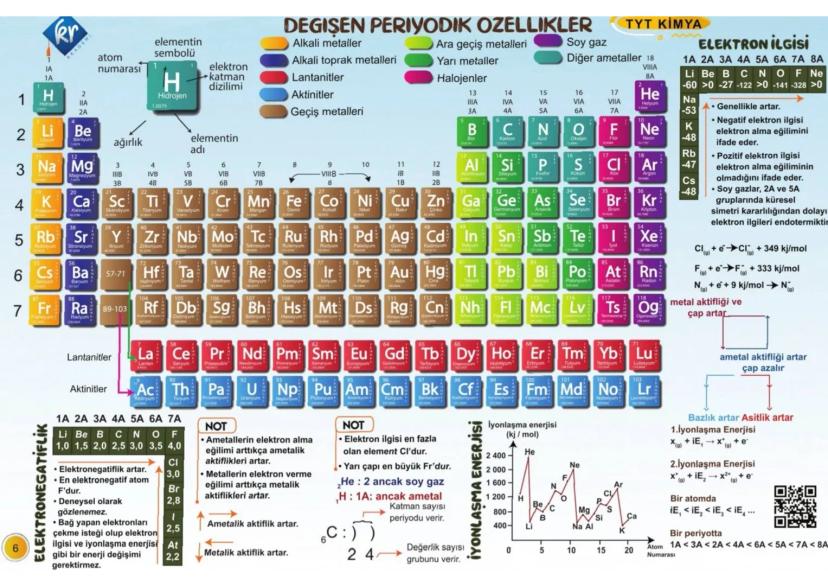
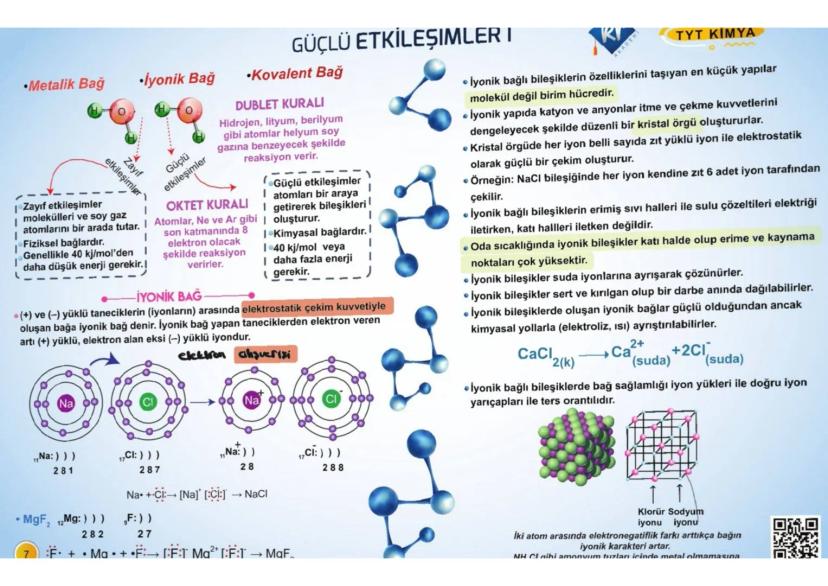
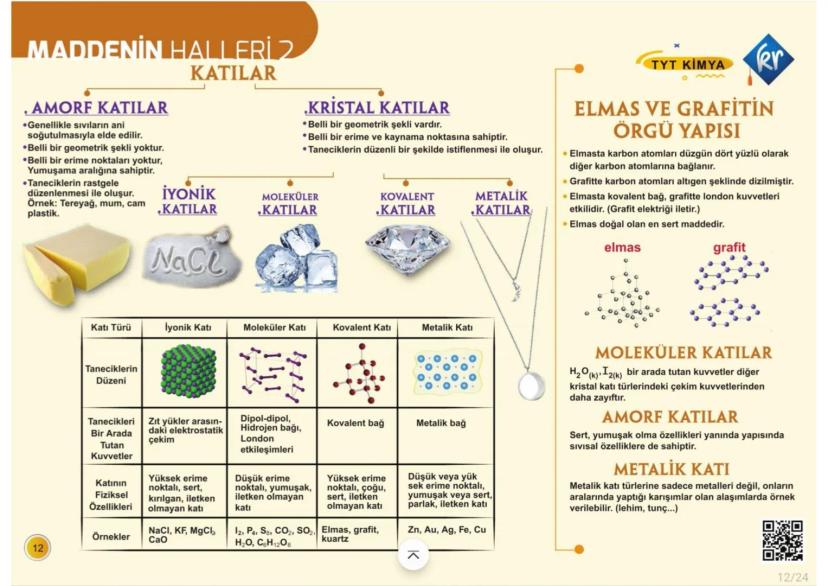
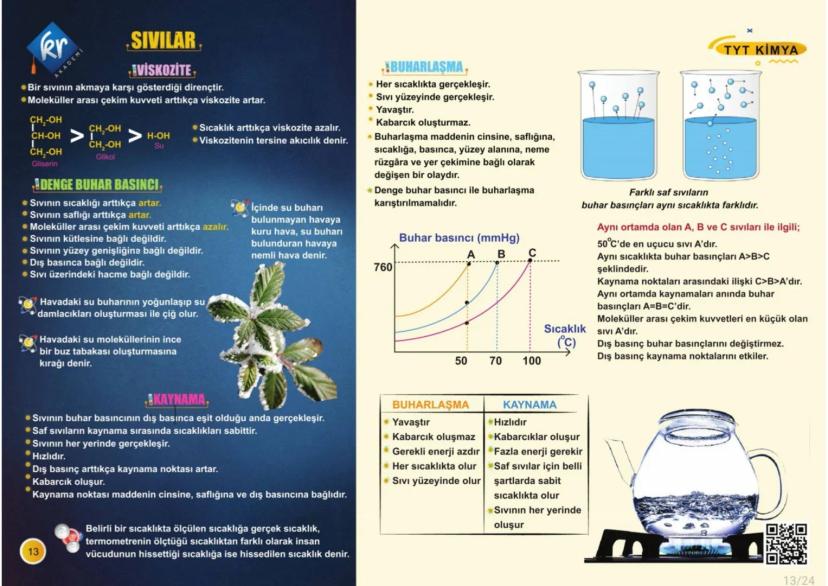
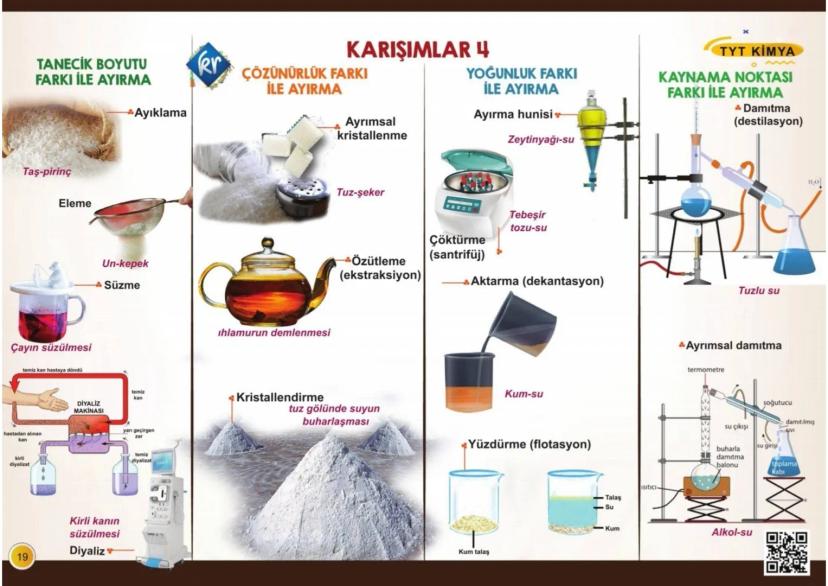
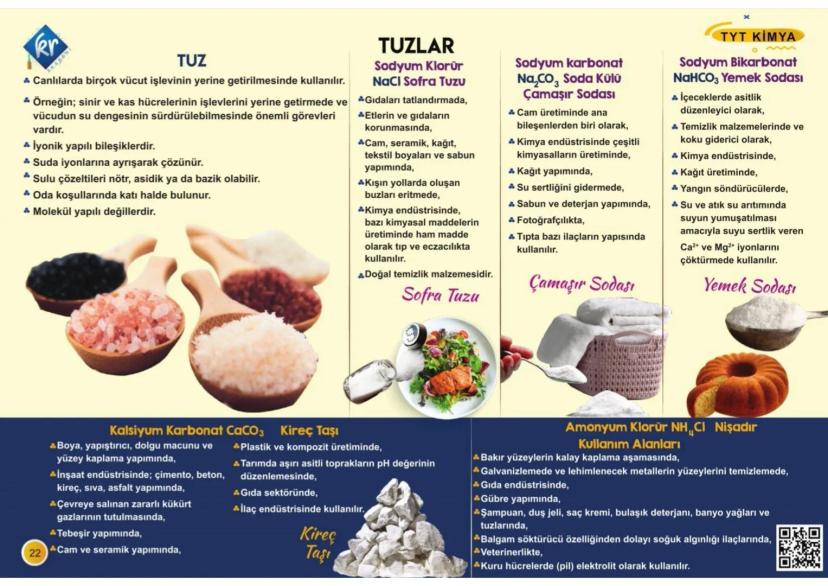
Atomun Yapısı ve Modeller
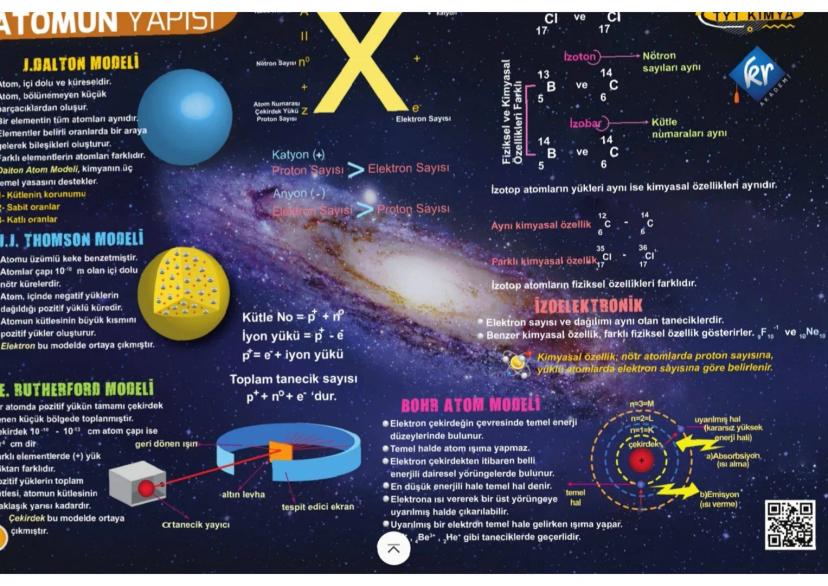
Atomun yapısını anlamak için bilim insanları farklı atom modelleri geliştirdi. Dalton atomu bölünmez küre olarak görürken, Thomson "üzümlü kek" modeli ile elektronları keşfetti.
Rutherford modeli devrim yarattı: Atomun merkezinde küçücük bir çekirdek var ve tüm pozitif yük burada toplanmış! Çekirdek atom çapının 10.000'de 1'i kadar küçük ama kütlenin yarısını barındırıyor.
Modern atomda proton sayısı = atom numarası eşitliği temel kural. İyonlar proton-elektron dengesizliğinden oluşuyor: fazla elektron (-) iyon, eksik elektron (+) iyon yapıyor.
İzotop, izoton, izobar kavramları sınav favorisi! İzotoplar aynı element ama farklı nötron sayısı. C-12 ve C-14 gibi izotopların kimyasal özellikleri aynı ama fiziksel özellikleri farklı.
💡 Sınav İpucu: İzoelektronik tanecikler (F⁻ ve Ne gibi) aynı elektron sayısına sahip ama farklı çekirdek yüküne sahip!
Bohr modeli elektronların belirli yörüngelerde döndüğünü söylüyor. Elektron enerji alınca üst yörüngeye çıkıyor, enerji verince alt yörüngeye iniyor ve ışık çıkarıyor.