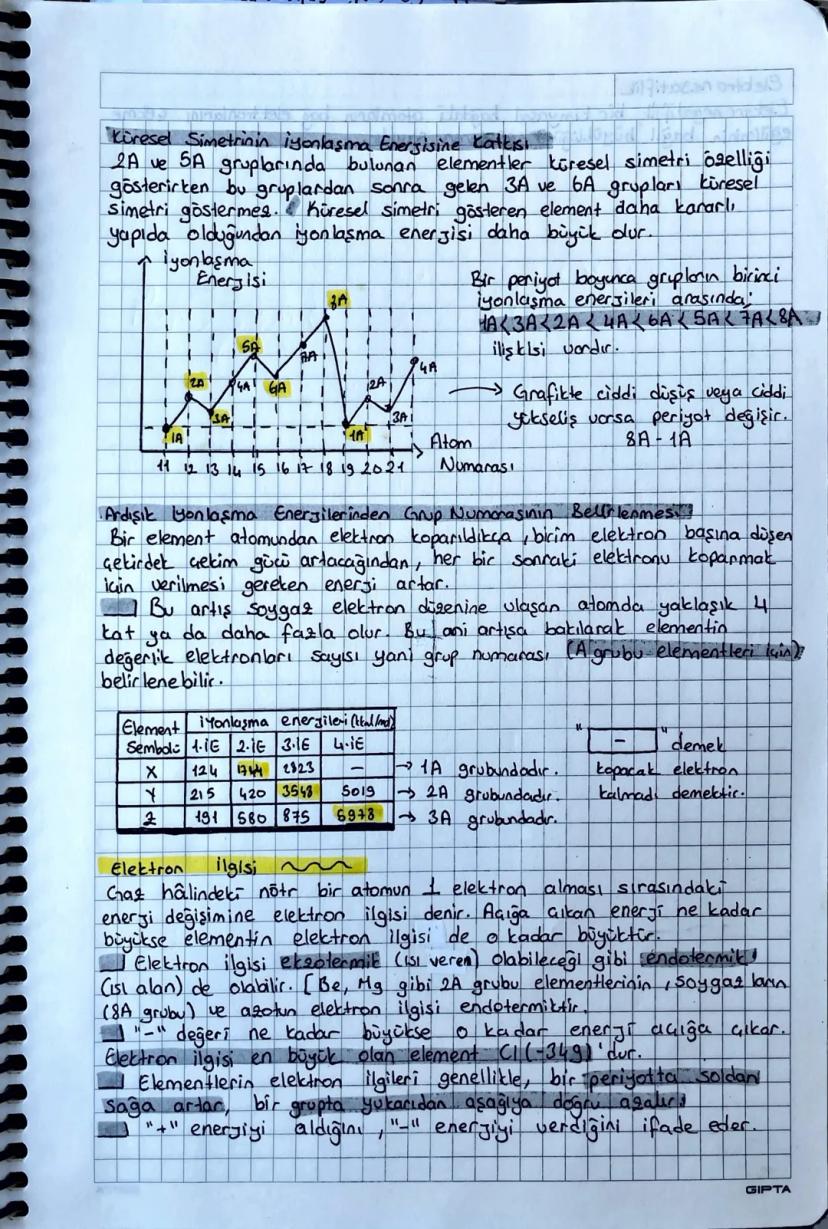
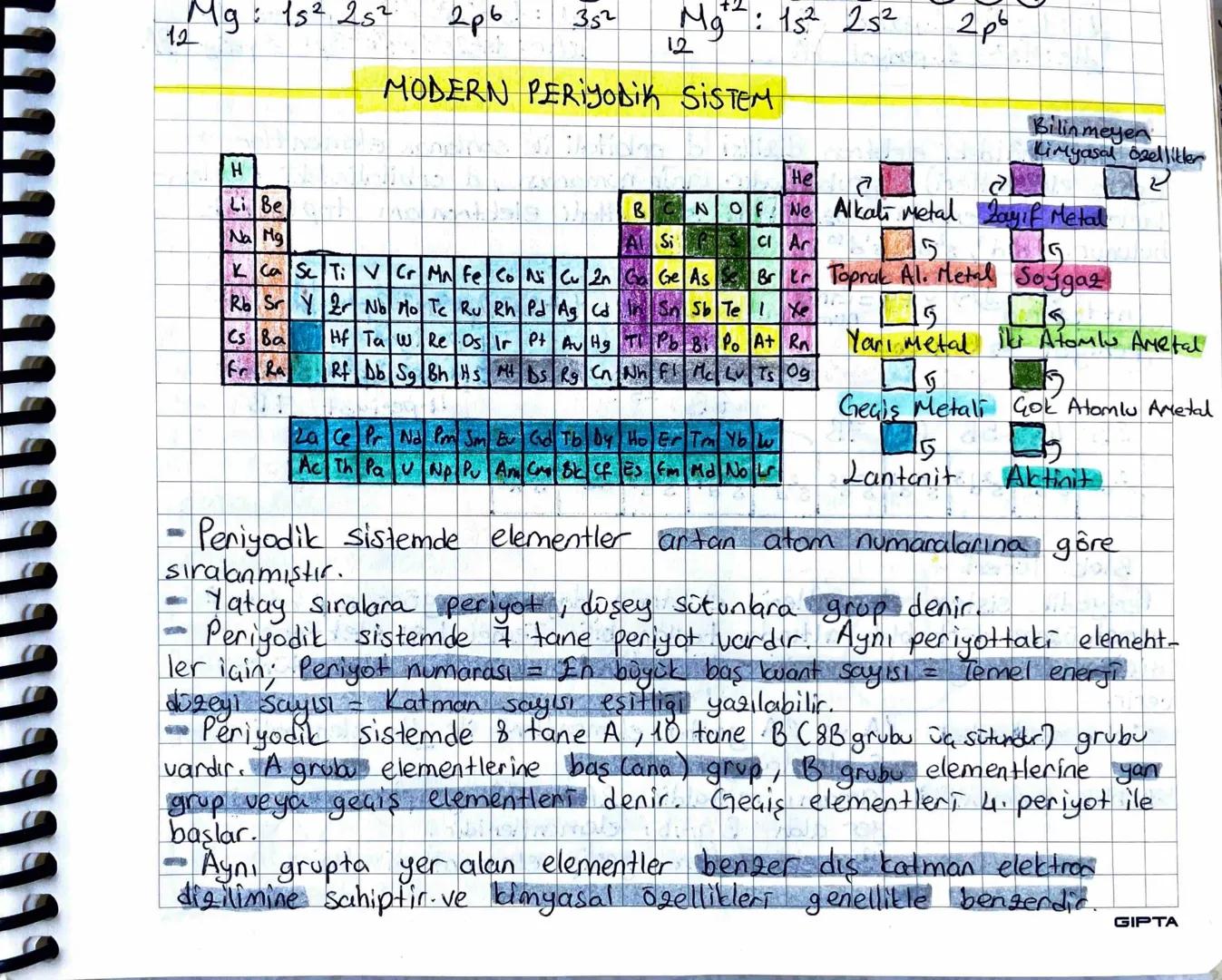
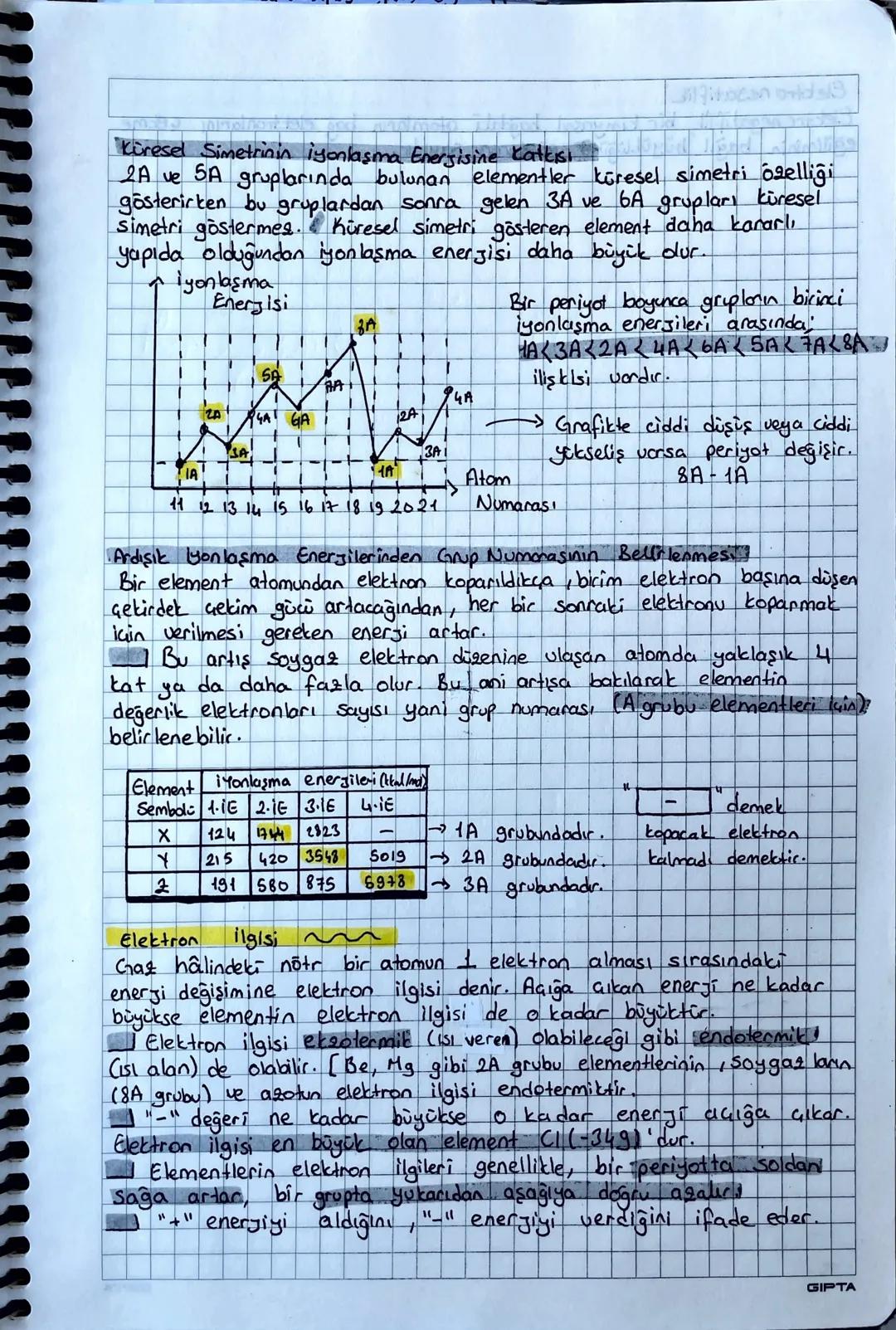
Blok Türleri ve Atom Yarıçapı
Blok türleri periyodik tablonun farklı bölgelerini gösterir: s blok 1A,2A+He, p blok 3A−8A, d blok (geçiş metalleri), f blok (iç geçiş metalleri).
Atom yarıçapları konusunda farklı türler var: Kovalent yarıçap (en küçük), iyonik yarıçap, metalik yarıçap ve Van der Waals yarıçapı (en büyük).
İyon yarıçapları için şu kuralı unutma: Katyon oluştuğunda çap küçülür (elektron kaybı), anyon oluştuğunda çap büyür (elektron kazancı).
Periyodik tabloda atom yarıçapları için "kardan adam kuralı" var: Sağa ve yukarı gittikçe çap küçülür! Bunun sebebi proton sayısının artmasıyla çekirdek çekim gücünün artması.
Sınav İpucu: İzoelektronik iyonlarda (aynı elektron sayısı) proton sayısı fazla olanın çapı daha küçüktür!