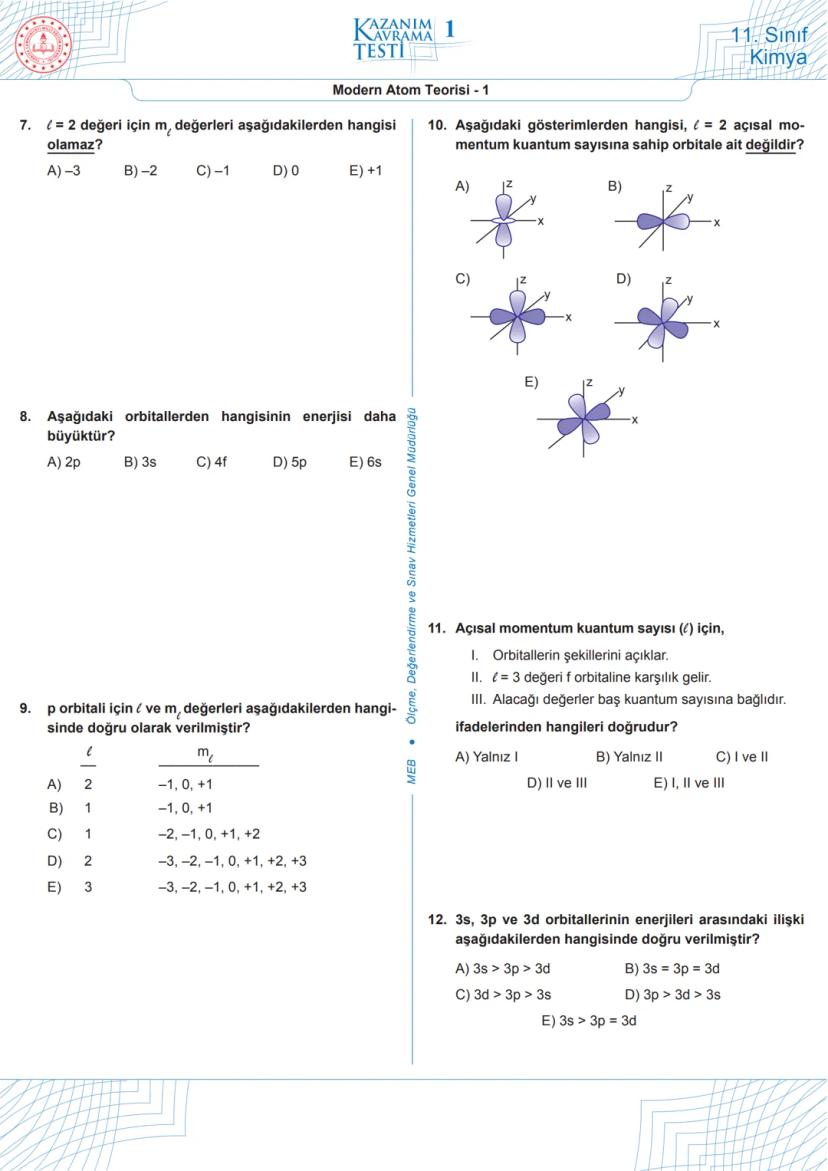
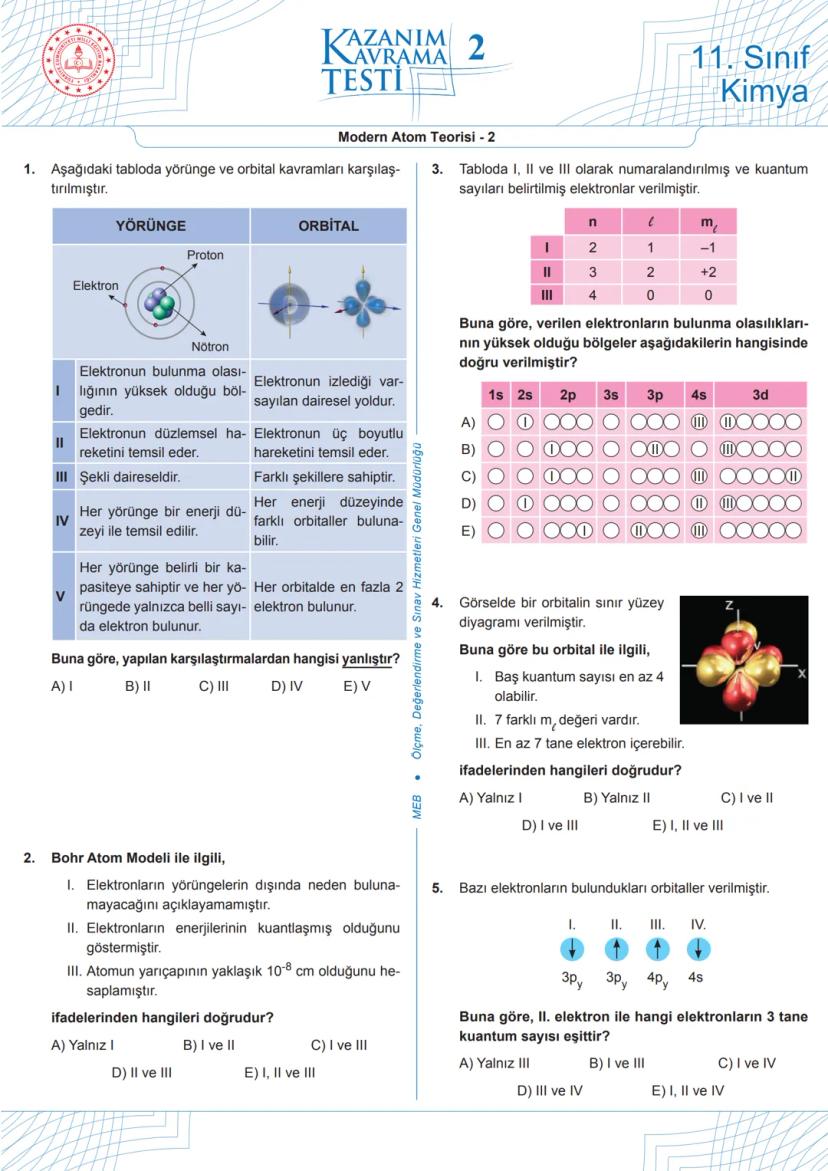
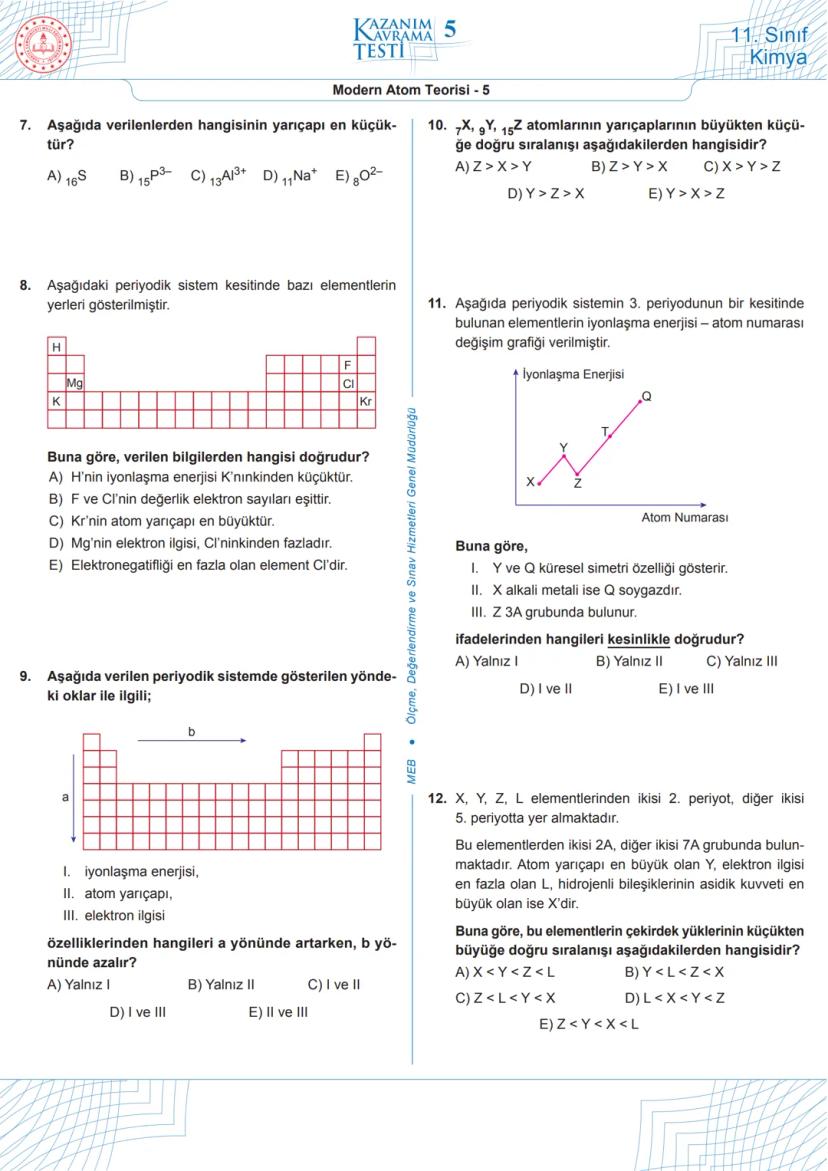
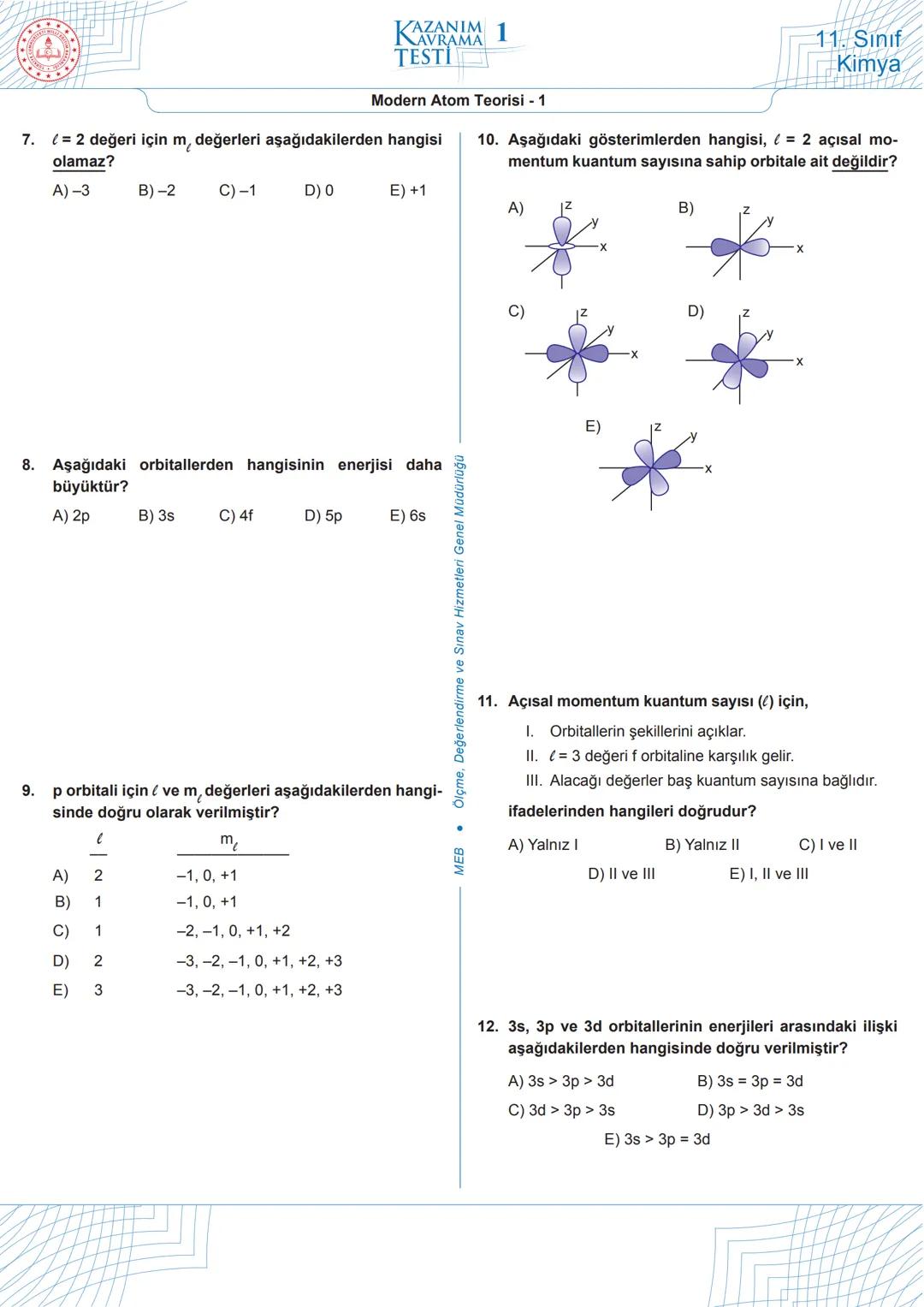
Modern Atom Teorisi - 5 (Devam)
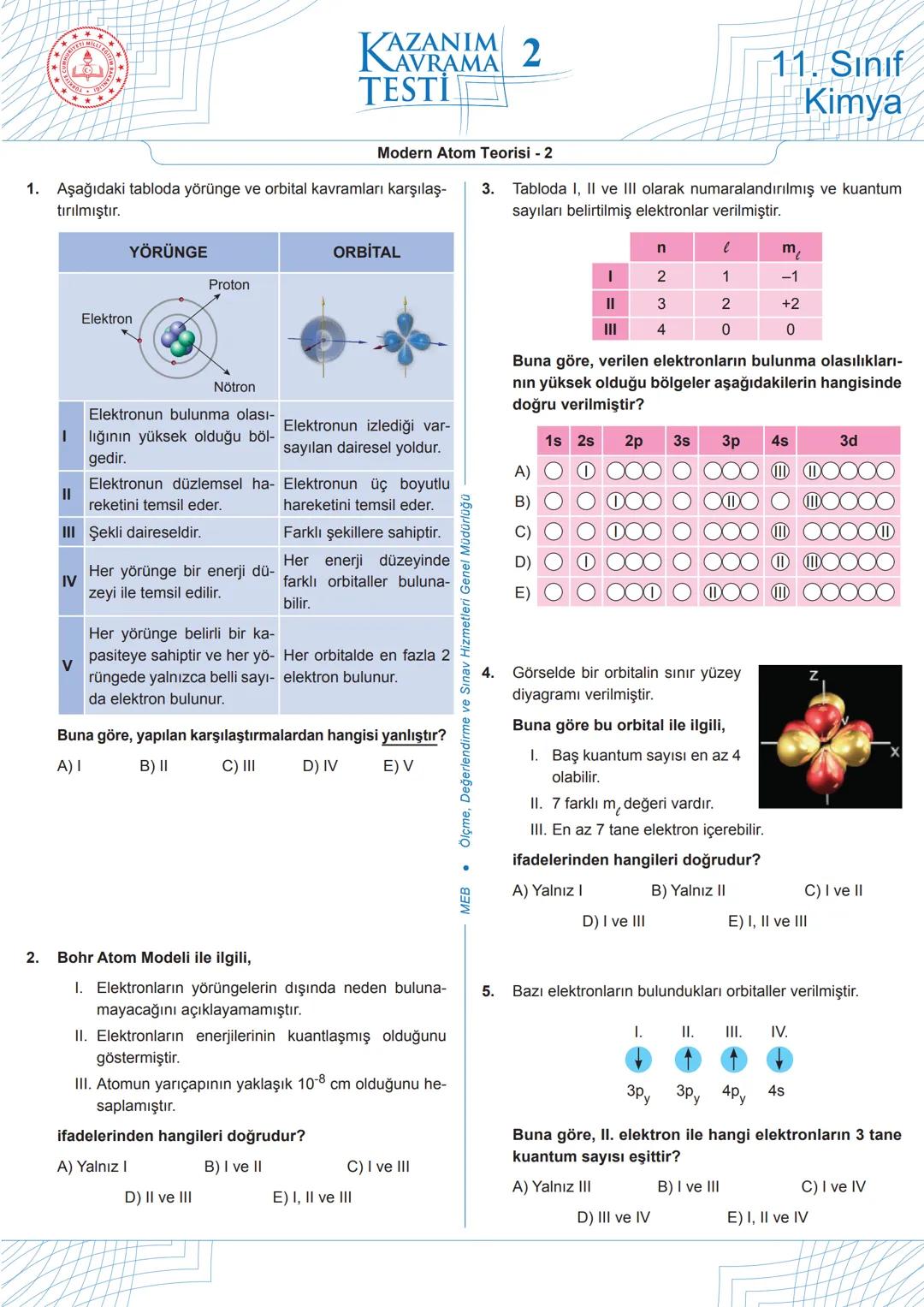
Elementlerin elektronegatifliği, elektronları çekme gücünü gösterir. Periyodik sistemde genellikle sağ üste doğru gidildikçe elektronegatiflik artar. En elektronegatif element flor (F)'dur. Hidrojen (H), flor (F), magnezyum (Mg), klor (Cl), potasyum (K) ve kripton (Kr) elementlerinden oluşan bir kesitte, elektronegatifliği en fazla olan element F'dur.
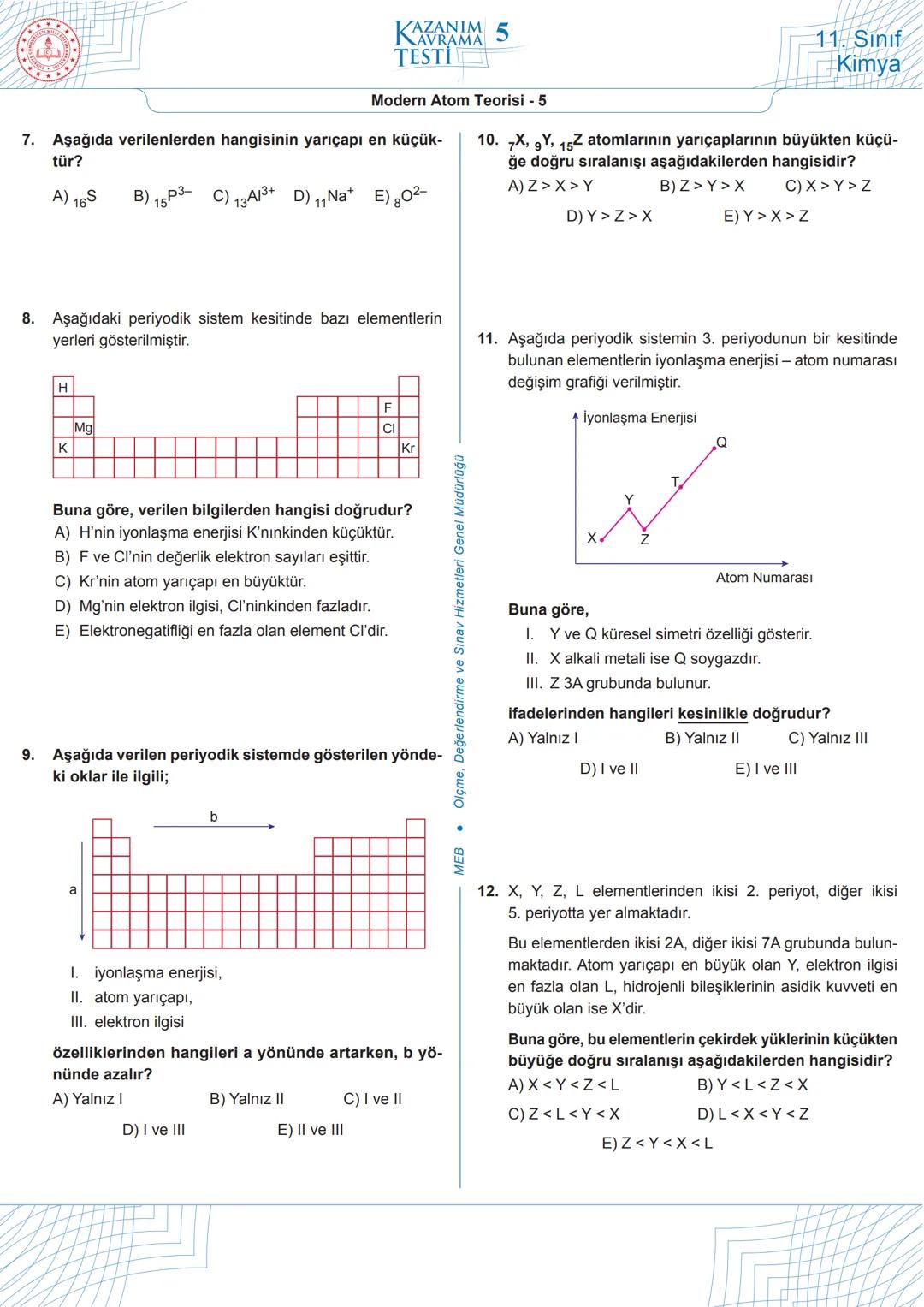
Atom yarıçapı, aynı grupta yukarıdan aşağıya doğru artar, aynı periyotta soldan sağa doğru azalır. Bu nedenle periyodik sistemde en büyük atom yarıçapına sahip elementler, sol altta yer alan alkali metallerdir. Örneğin, H, F, Mg, Cl, K, Kr elementleri arasında atom yarıçapı en büyük olan K'dır.
İyonlaşma enerjisi, periyodik sistemde genellikle sağ üste doğru gidildikçe artar. Bu nedenle soy gazların iyonlaşma enerjileri çok yüksektir. Periyodik sistemdeki elementlerin iyonlaşma enerjisi - atom numarası grafiğinde, soy gazlar zirve noktalarını oluşturur.
Elementlerin elektron ilgisi, genellikle halojenler için en yüksektir. Elektron ilgisi, periyodik sistemde soldan sağa doğru genellikle artar, yukarıdan aşağıya doğru ise değişkenlik gösterebilir.
⚠️ Dikkat: İzolektronik türlerin elektron sayıları aynıdır ancak proton sayıları farklıdır. Örneğin, O²⁻, F⁻, Ne, Na⁺, Mg²⁺ hepsi 10 elektronludur. İzolektronik türlerde, proton sayısı arttıkça yarıçap küçülür.
Periyodik sistemdeki elementlerin hidrojenli bileşiklerinin asidik kuvveti, genellikle aynı periyotta soldan sağa doğru artar. Bu özellik, elementlerin elektronegatifliği ile yakından ilişkilidir.