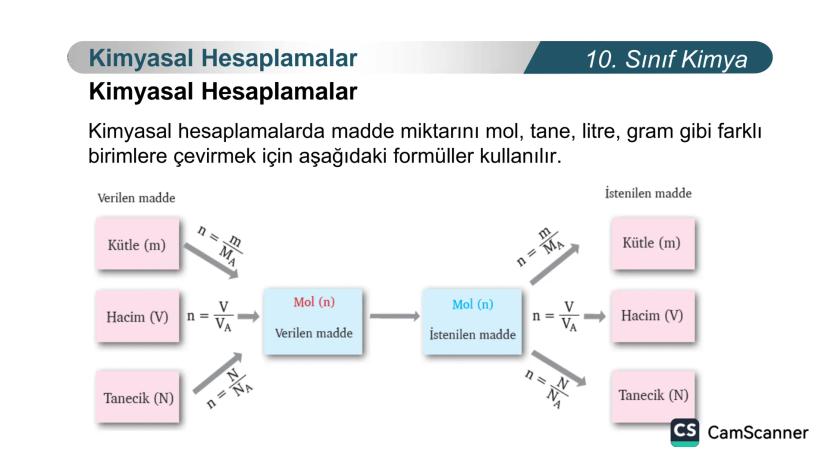
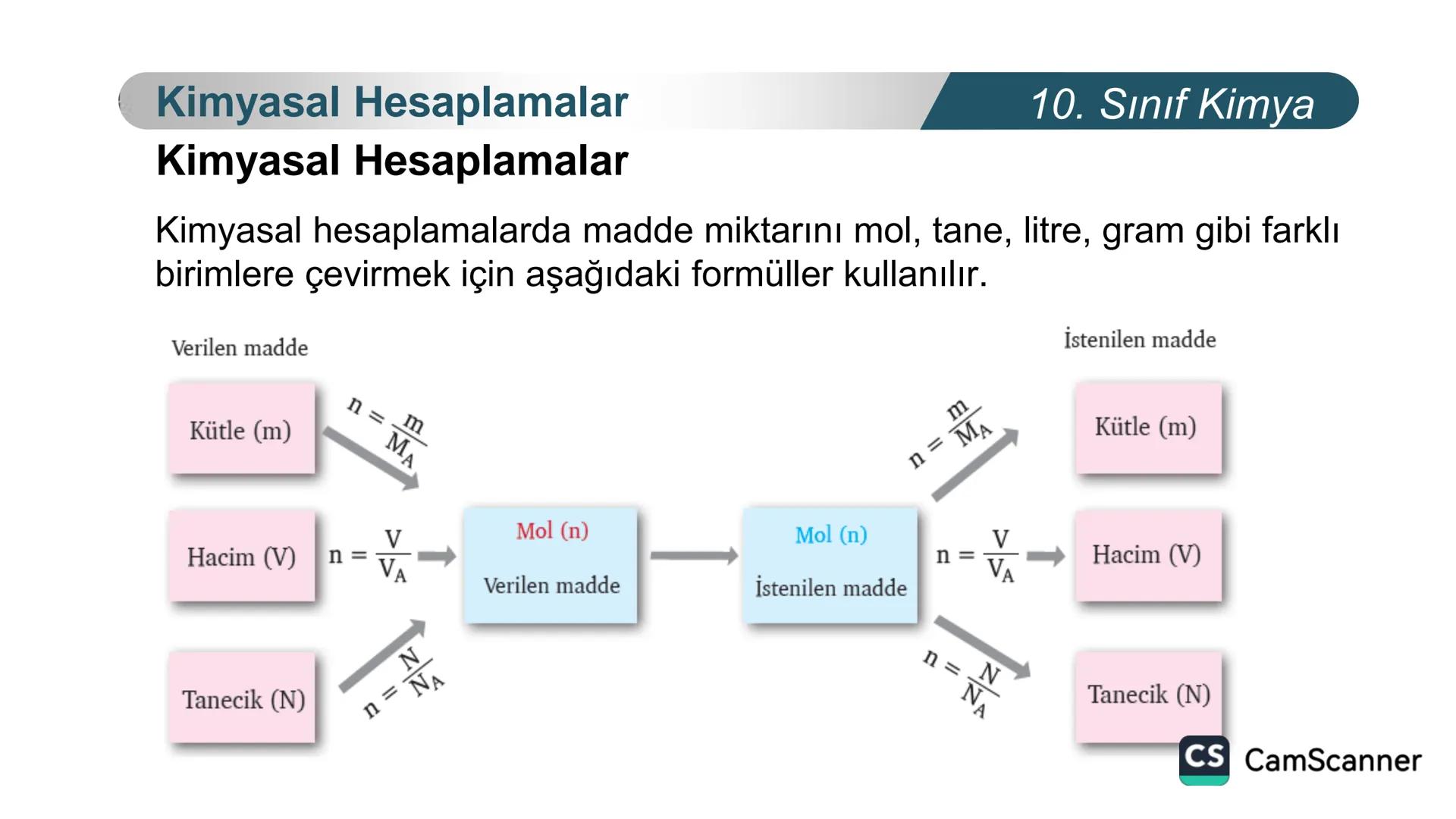
Tepkimede Tanecik ve Hacim Hesapları
2Al(k) + 6HCl(suda) → 2AlCl₃(suda) + 3H₂(g) tepkimesinde oluşan H₂ gazının hacmi 6,72 litre ise:
a) Al atomu sayısını bulmak için önce H₂'nin mol sayısını hesaplamalısın. Normal koşullarda 1 mol gaz 22,4 litre olduğundan, 6,72/22,4 = 0,3 mol H₂ oluşmuş demektir. Tepkime denklemine göre, 3 mol H₂ oluştuğunda 2 mol Al harcanır. Buradan 0,3 mol H₂ oluşması için 0,3 × (2/3) = 0,2 mol Al harcanır. Bu da 0,2 mol × 6,02 × 10²³ = 1,204 × 10²³ Al atomu demektir.
b) HCl miktarını bulmak için: 0,3 mol H₂ × 6molHCl/3molH2 = 0,6 mol HCl harcanmıştır.
c) AlCl₃ kütlesini hesaplamak için önce mol sayısını bul: 0,3 mol H₂ × 2molAlCl3/3molH2 = 0,2 mol AlCl₃ oluşur. AlCl₃'ün mol kütlesi = 27 + 3 × 35,5 = 133,5 g/mol. Bu durumda 0,2 mol × 133,5 g/mol = 26,7 gram AlCl₃ oluşur.
💫 Hatırlatma: Normal koşullar (NŞA), 0°C sıcaklık ve 1 atmosfer basınçtır. Bu koşullarda 1 mol gaz 22,4 litre hacim kaplar. Bu bilgi gaz hesaplamalarında çok işine yarayacak!