Mol Hesaplamaları
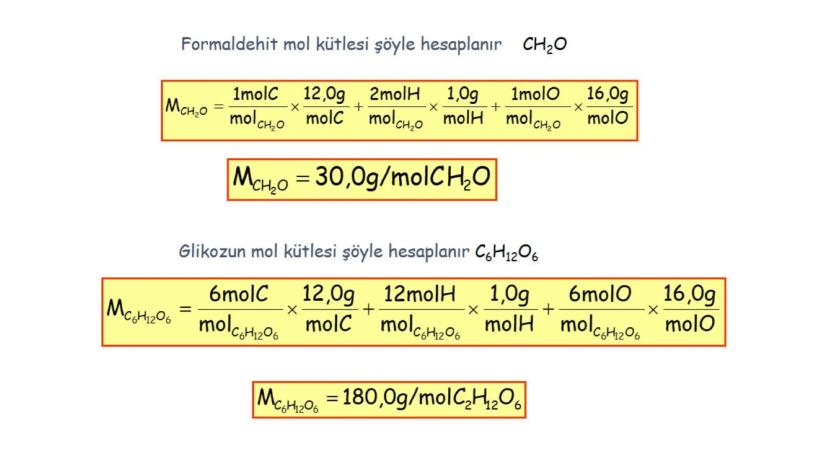
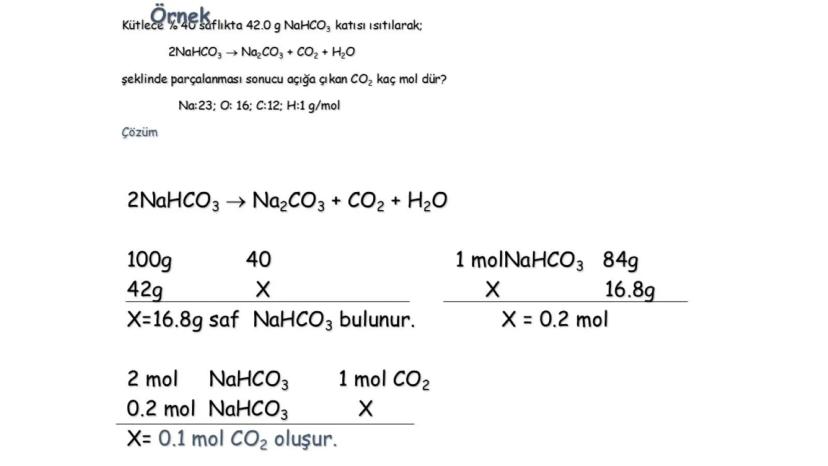
Mol hesaplamaları, bir maddenin kütlesiyle mol sayısı arasındaki dönüşümleri yapmamızı sağlar. Temel formül:
Mol sayısı = Maddenin kütlesi (g) / Mol kütlesi g/mol
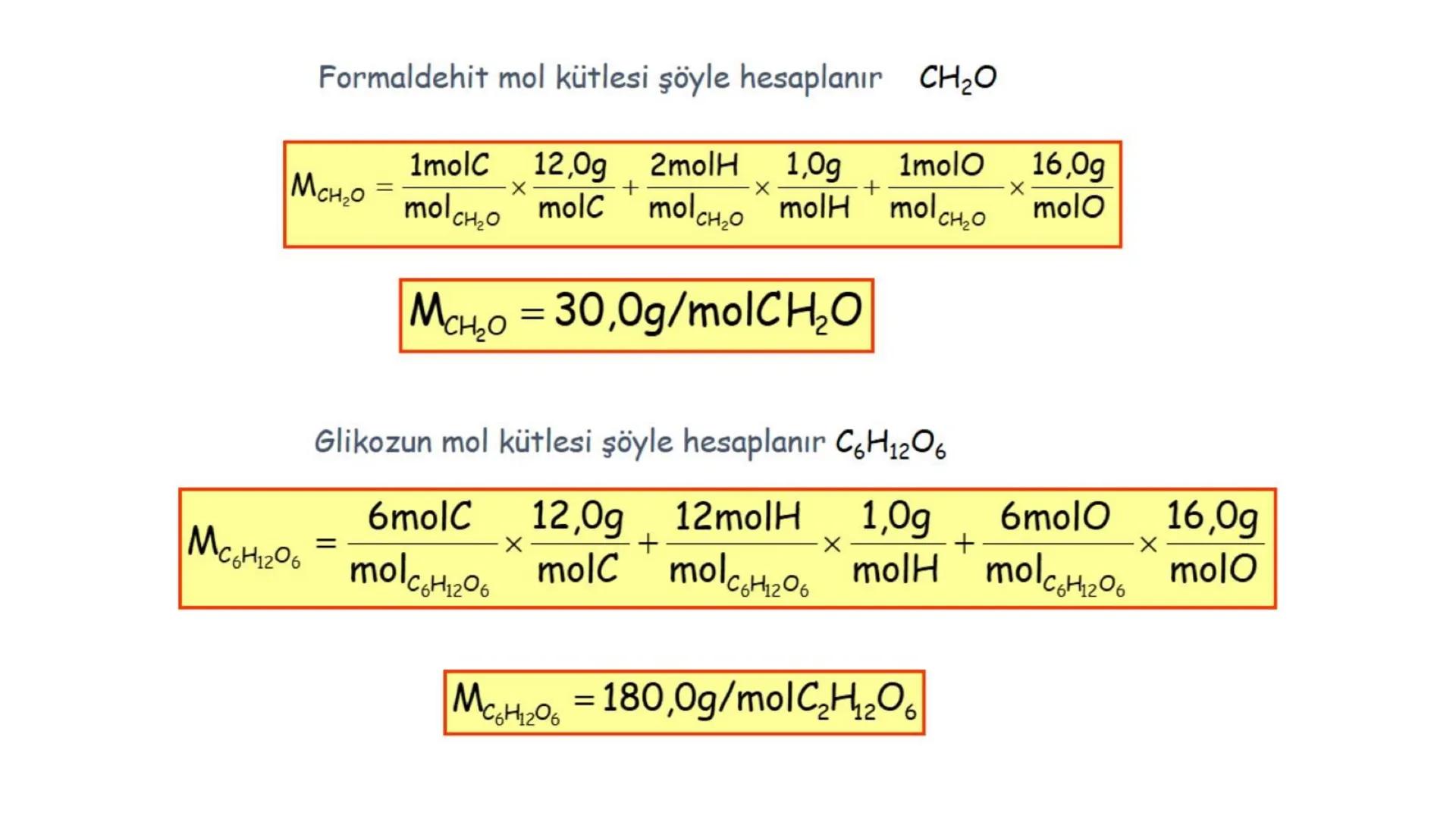
Örneğin, 2,00 gram benzoik asitin molku¨tlesi122,1g/mol kaç mol olduğunu hesaplamak için:
Mol sayısı = 2,00 g / 122,1 g/mol = 0,0164 mol benzoik asit
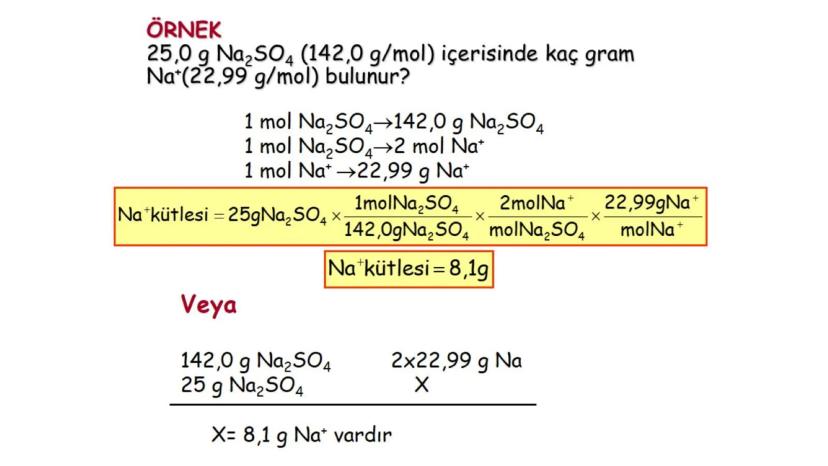
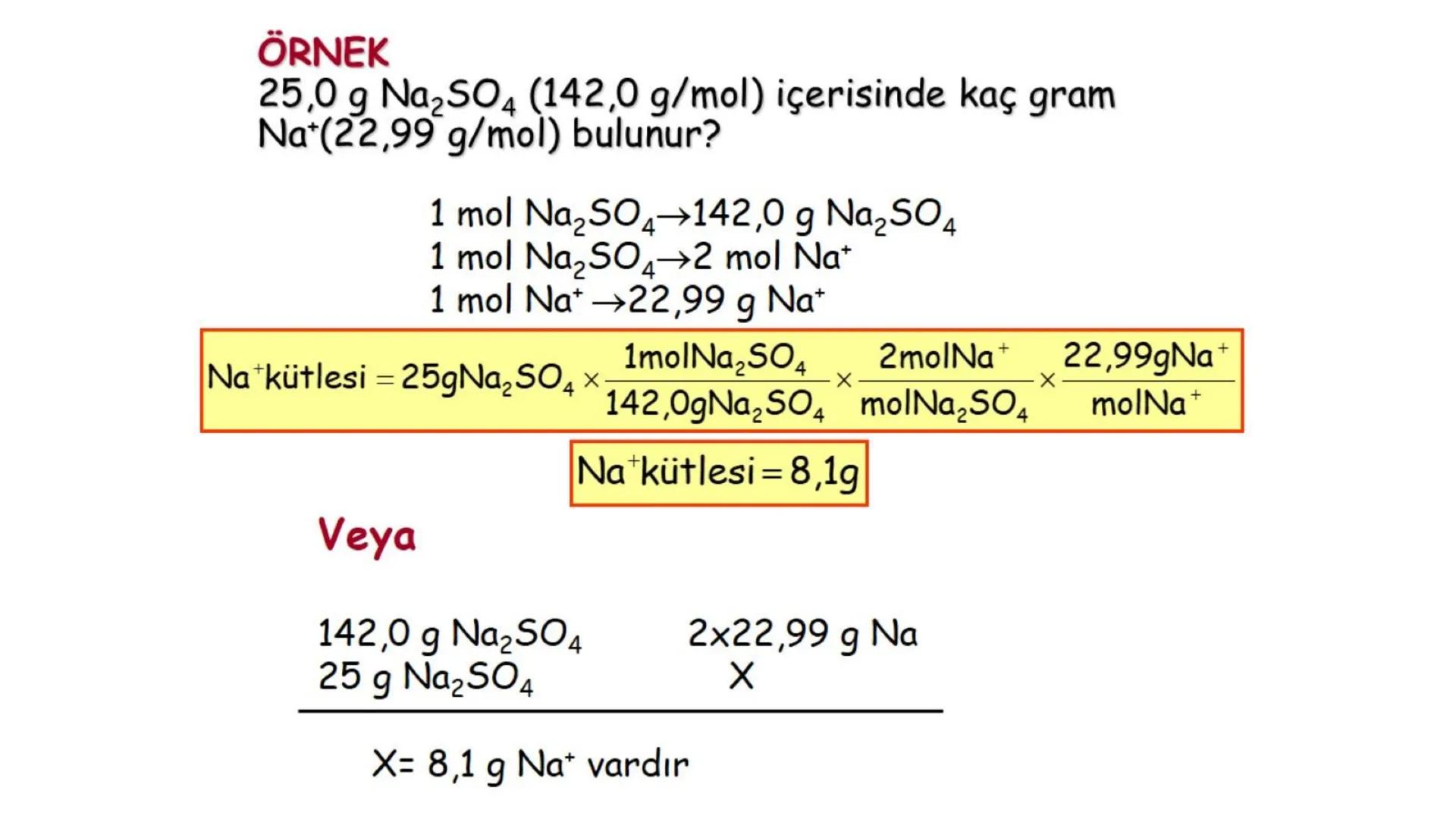
Bir bileşik içindeki bir elementin miktarını hesaplamak için de mol kavramını kullanırız. Örneğin, 25,0 g Na2SO4 içindeki Na miktarını hesaplarken:
- Na2SO4'ün mol kütlesi = 142,0 g/mol
- 25 g Na2SO4 × 2molNa/1molNa2SO4 × 22,99gNa/1molNa = 8,1 g Na
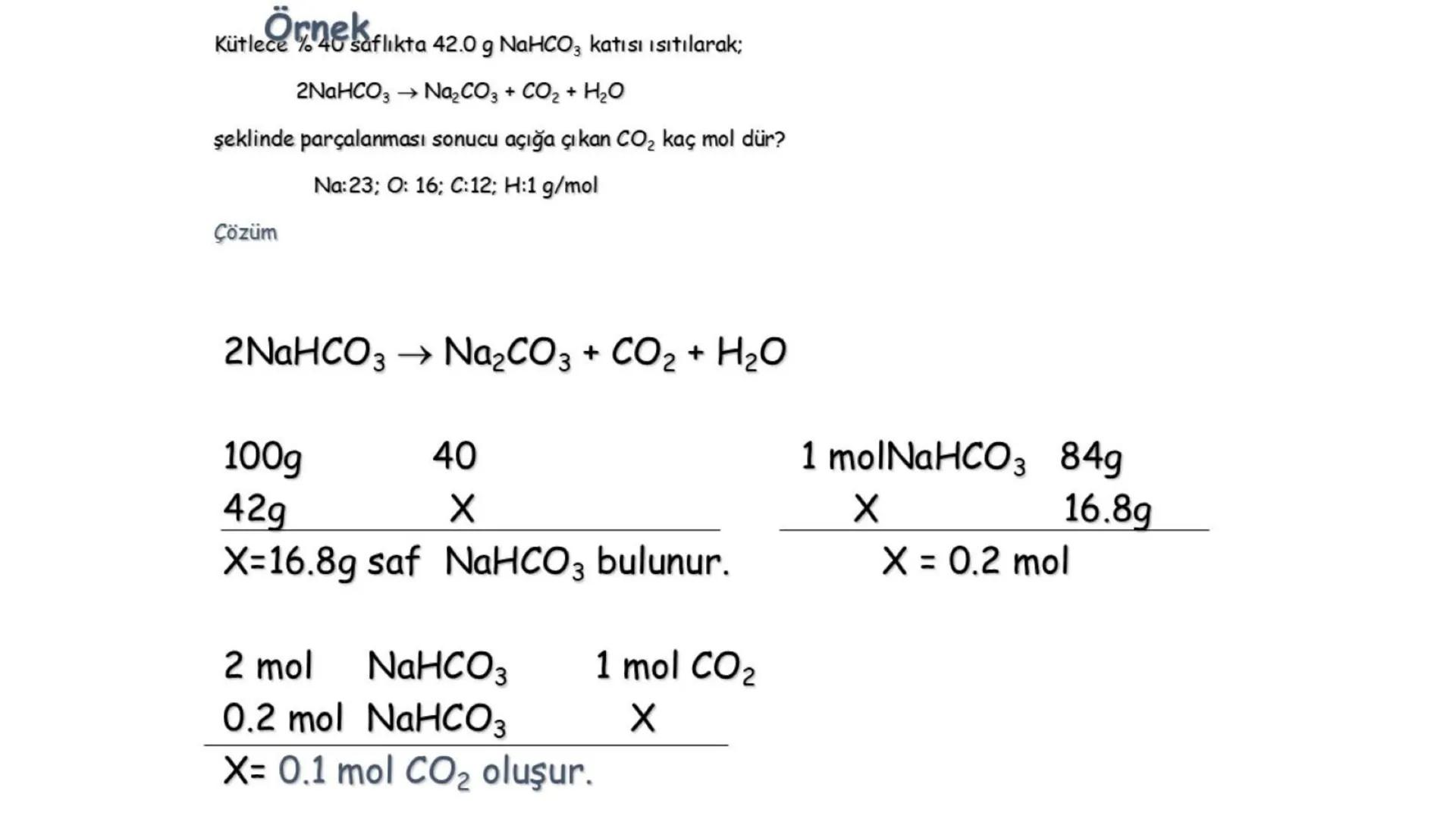
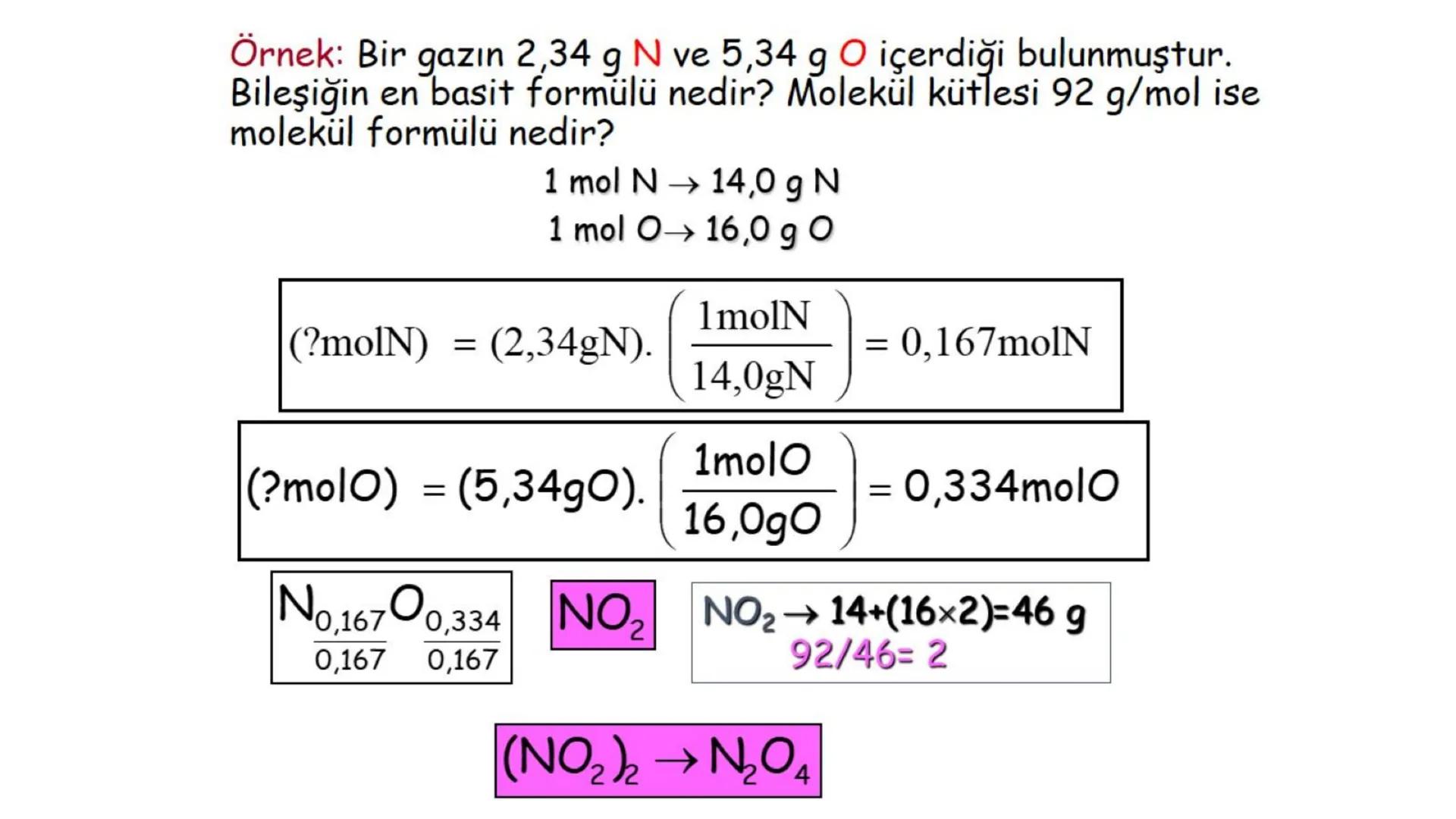
Püf nokta: Mol hesaplamalarında birim kontrolü yapmak çok önemlidir! Birimlerin birbirini götürdüğünden emin ol.