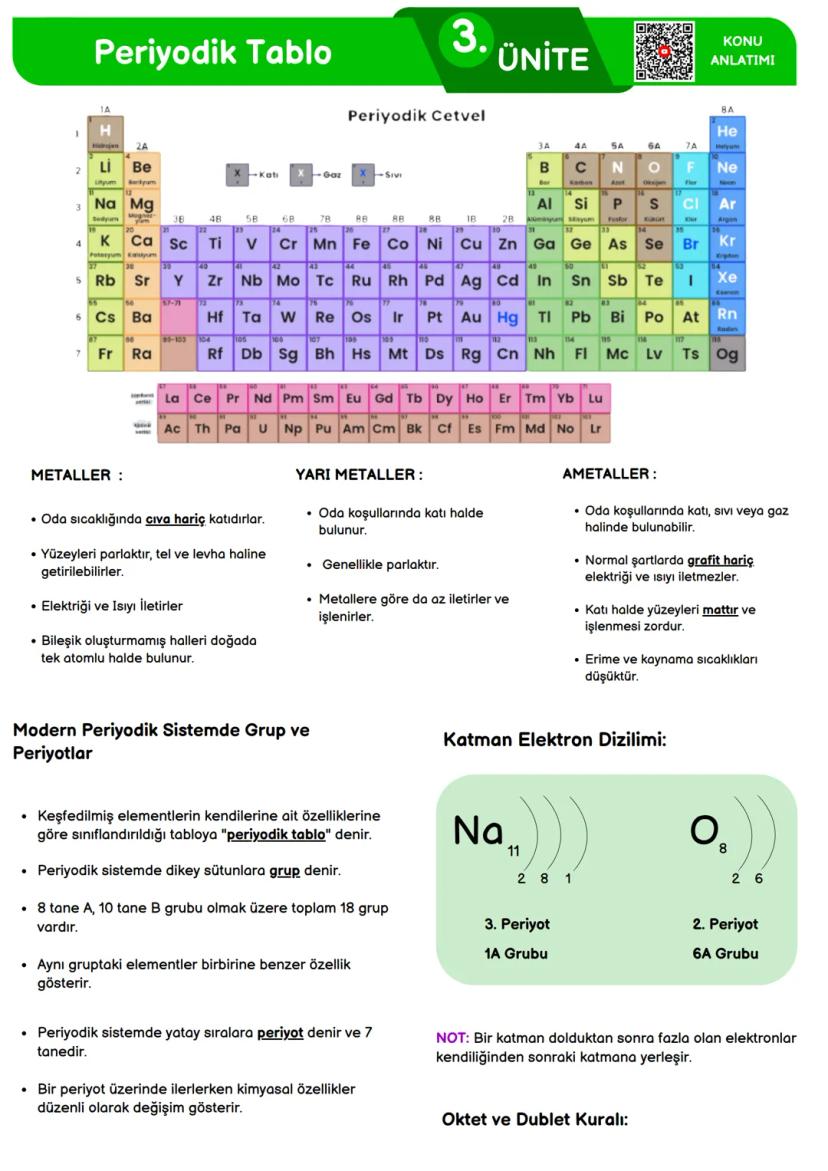
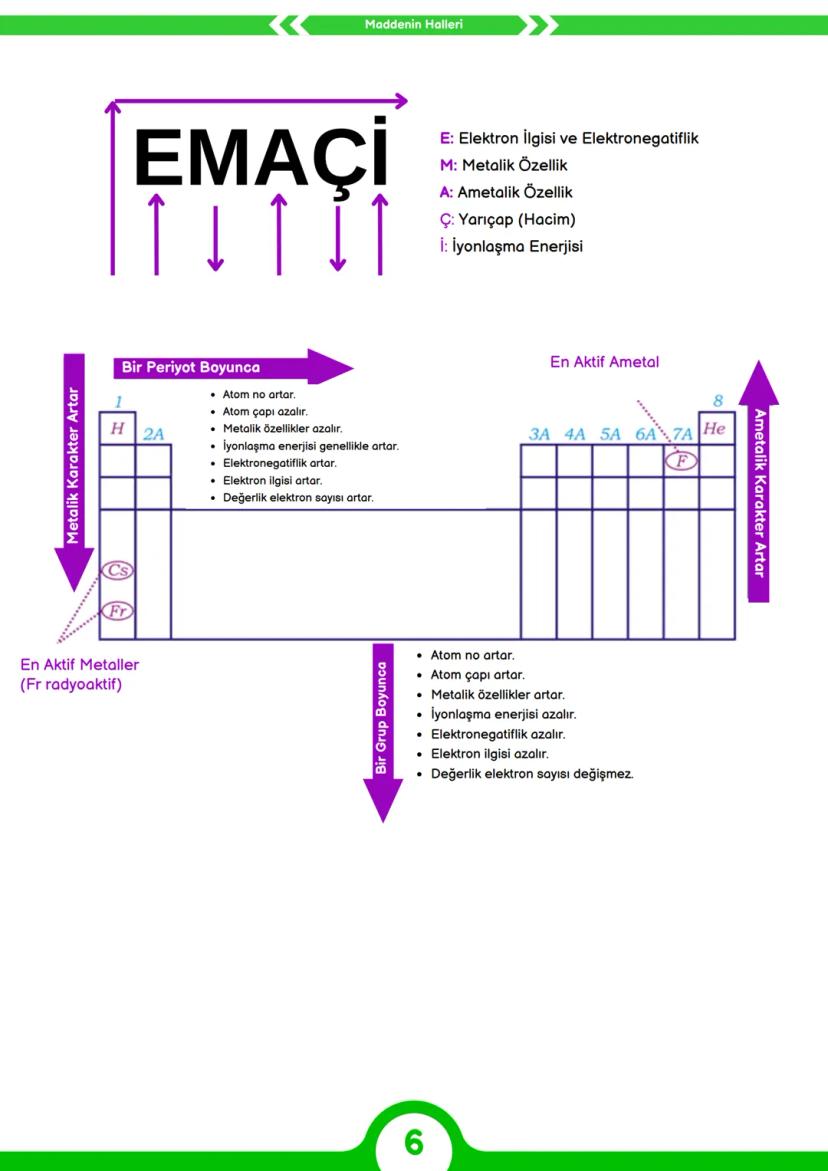
Türler Arası Etkileşimler
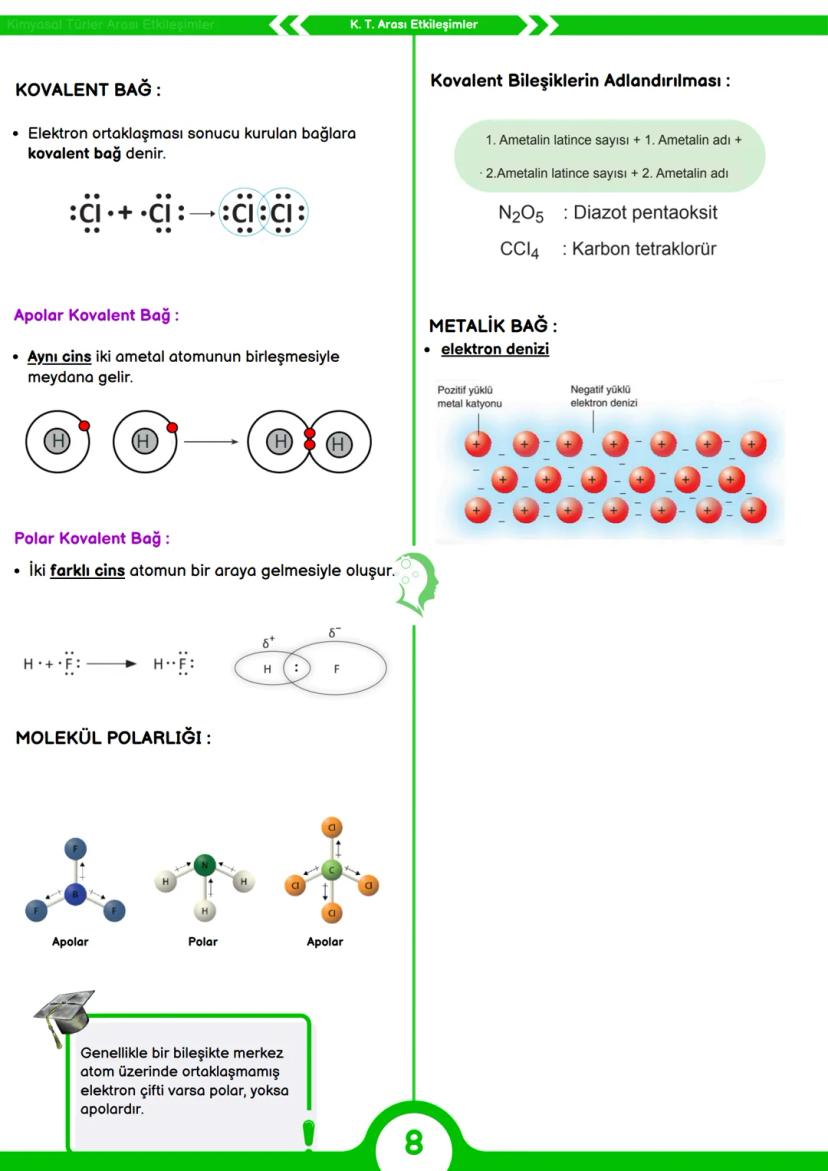
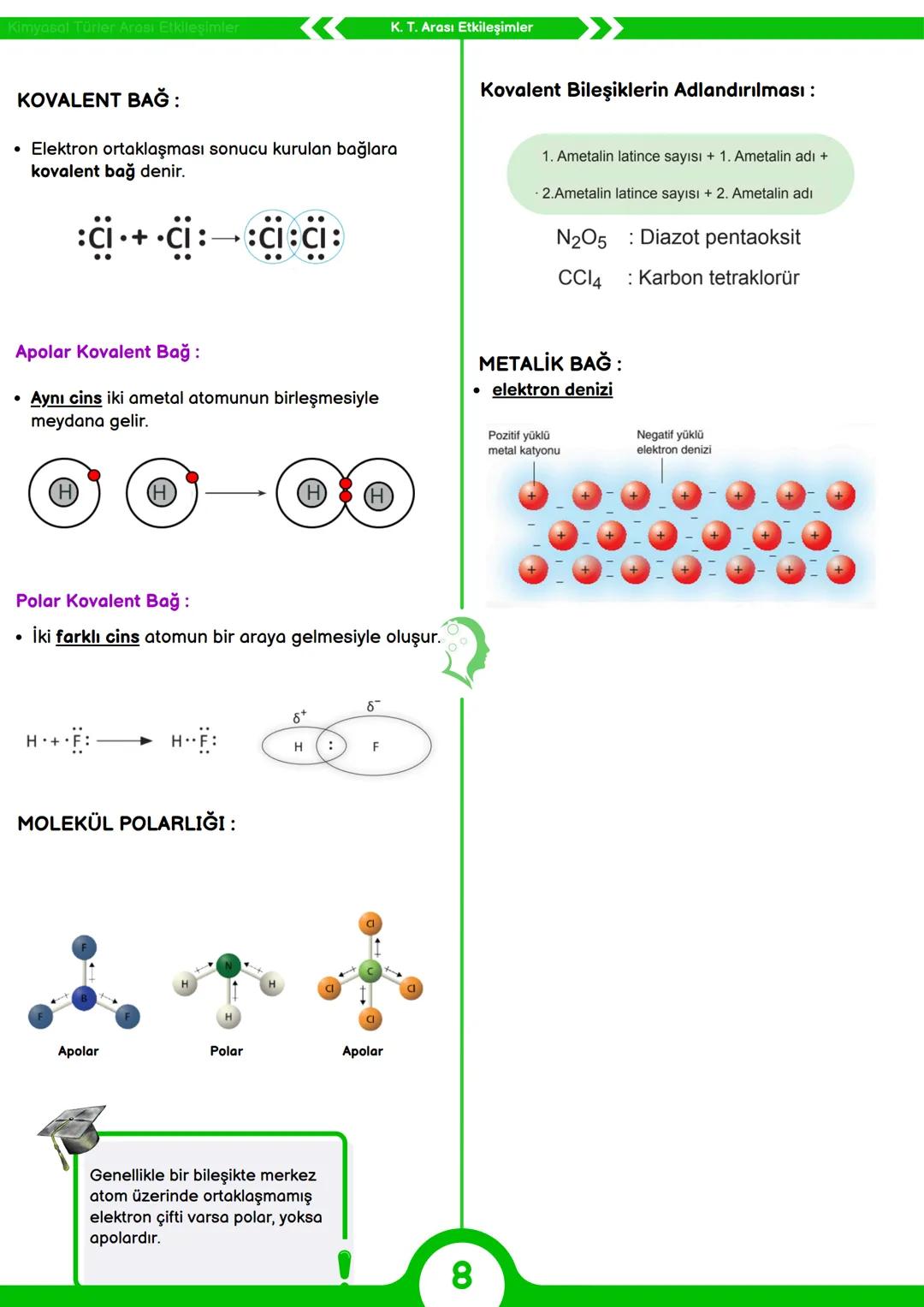
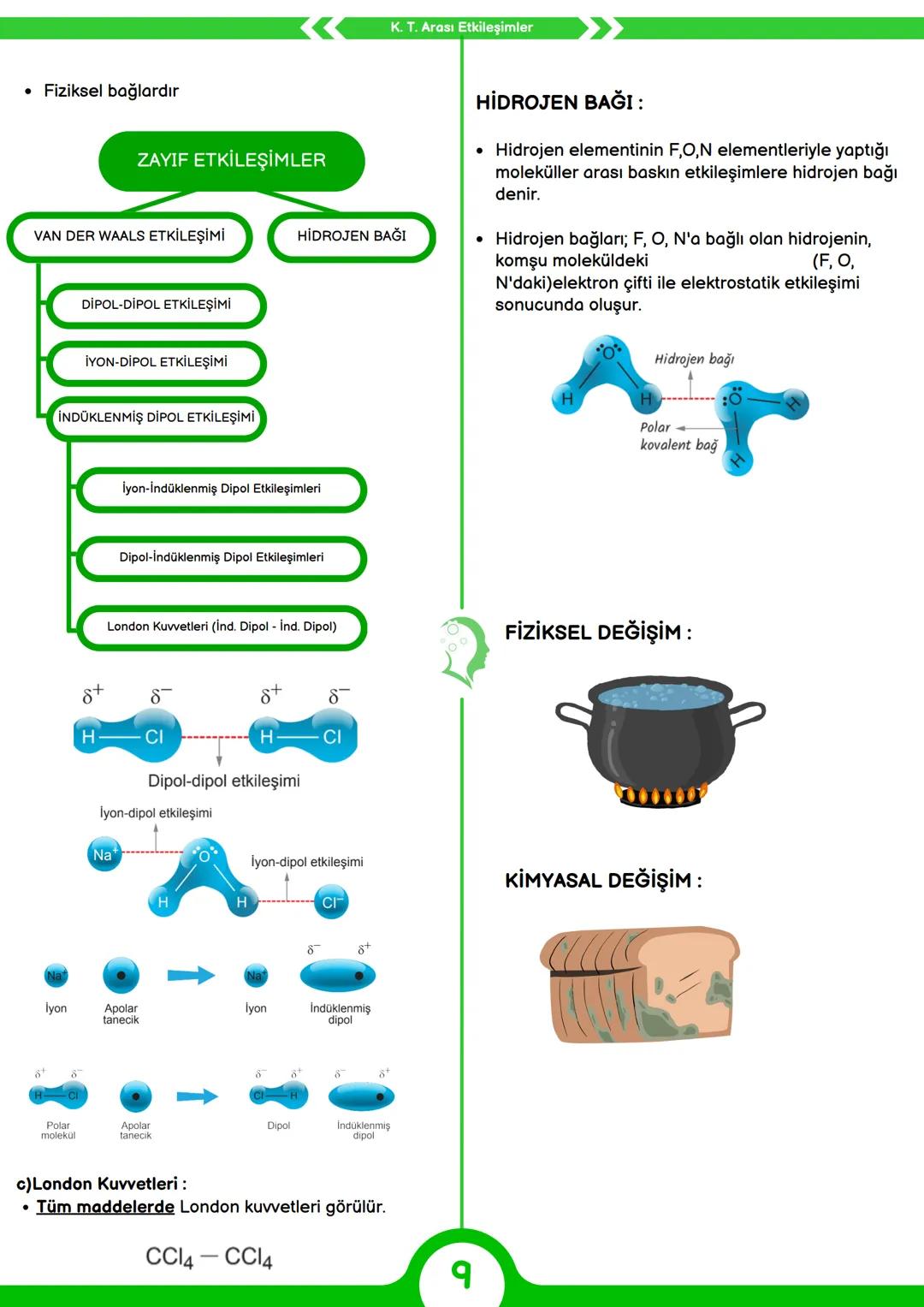
Elementler birbirleriyle etkileşime girerek bağlar oluşturur. Bu bağlar, güçlü etkileşimler (iyonik, kovalent, metalik) ve zayıf etkileşimler (van der Waals, hidrojen bağı) olarak ikiye ayrılır.
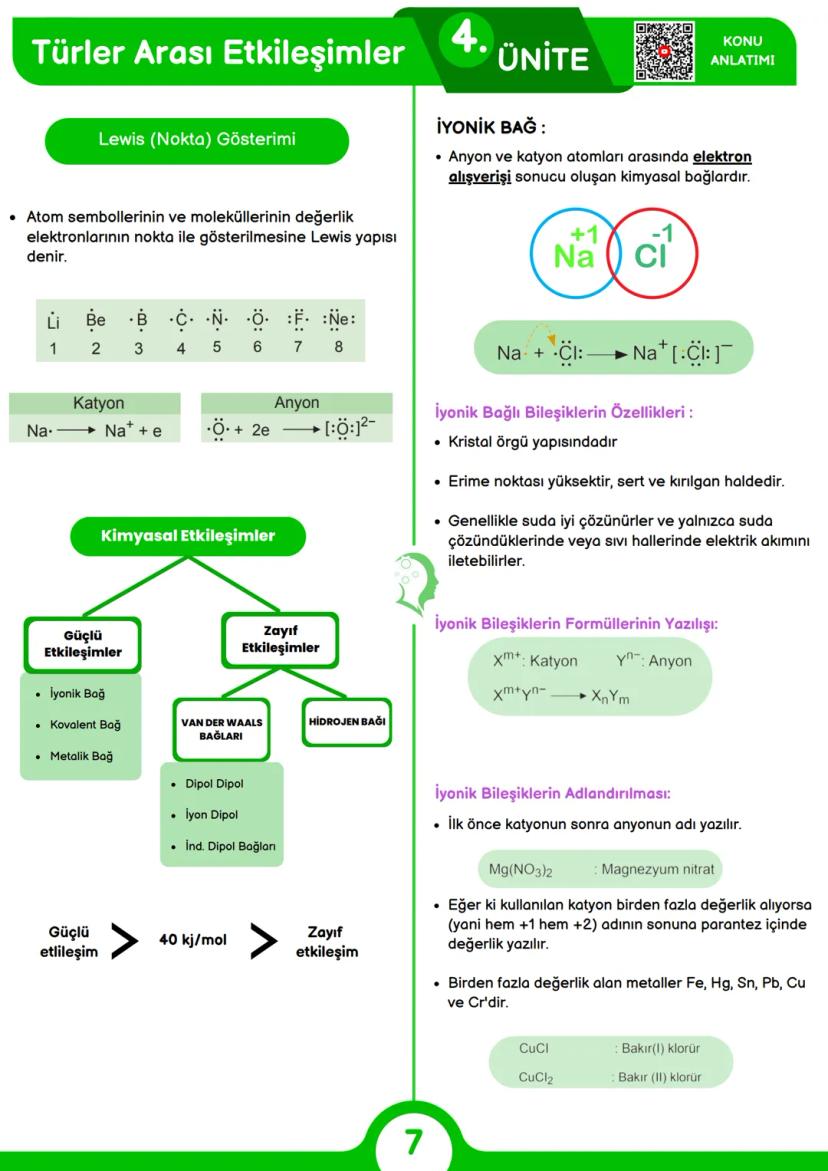
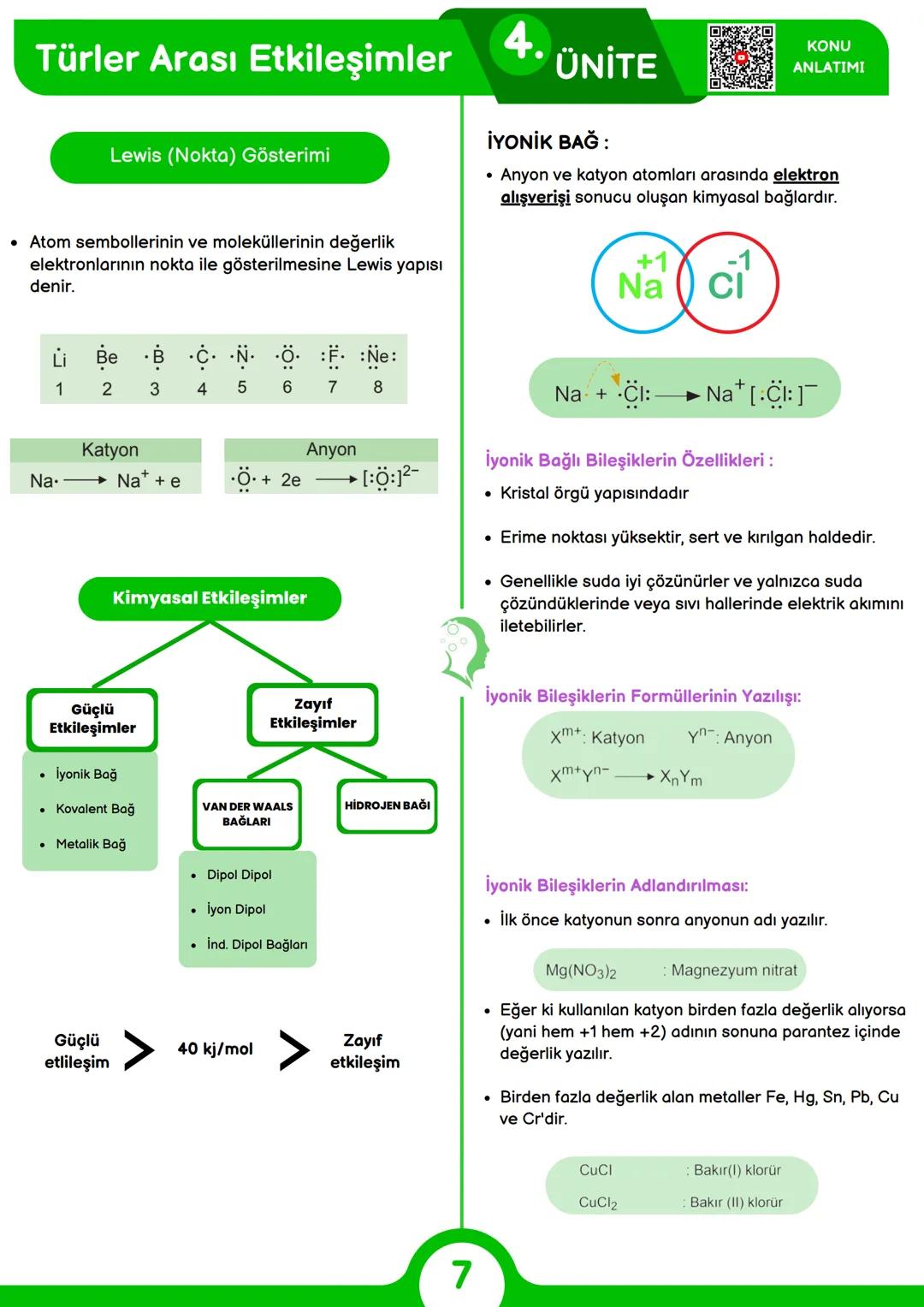
İyonik bağ, bir metal ile ametal arasında elektron alışverişi sonucu oluşur. Metal elektron vererek pozitif yüklü katyon, ametal elektron alarak negatif yüklü anyon haline gelir. Örneğin, Na+ ve Cl- iyonları arasında iyonik bağ vardır. İyonik bileşikler genellikle kristal yapıdadır, sert ve kırılgandır, yüksek erime noktalarına sahiptir ve çözeltileri elektrik iletir.
İyonik bileşiklerin formülü yazılırken katyonun ve anyonun yükleri çapraz yazılır: Xm+ + Yn- → XnYm. Örneğin, Mg2+ ve NO3- iyonlarından Mg(NO3)2 bileşiği oluşur.
İyonik bileşikler adlandırılırken önce katyonun, sonra anyonun adı yazılır. Örneğin NaCl "sodyum klorür" olarak adlandırılır. Birden fazla değerlik alabilen metaller (Fe, Hg, Sn, Pb, Cu, Cr) parantez içinde Roma rakamıyla belirtilir: CuCl "bakır(I) klorür", CuCl2 "bakır(II) klorür" gibi.
Hatırlatma: Elementlerin değerlik elektronlarını noktalarla gösterdiğimiz Lewis yapısı, bağ oluşumunu anlamada çok önemlidir. Metal-ametal etkileşimlerinde iyonik bağ, ametal-ametal etkileşimlerinde kovalent bağ oluşur!