Kovalent Bağ ve Elektronların Ortaklaşa Kullanılması
Ametal atomları birbirleriyle bağ yaparken nasıl davranır? İşte bu sorunun cevabı kovalent bağda gizli!
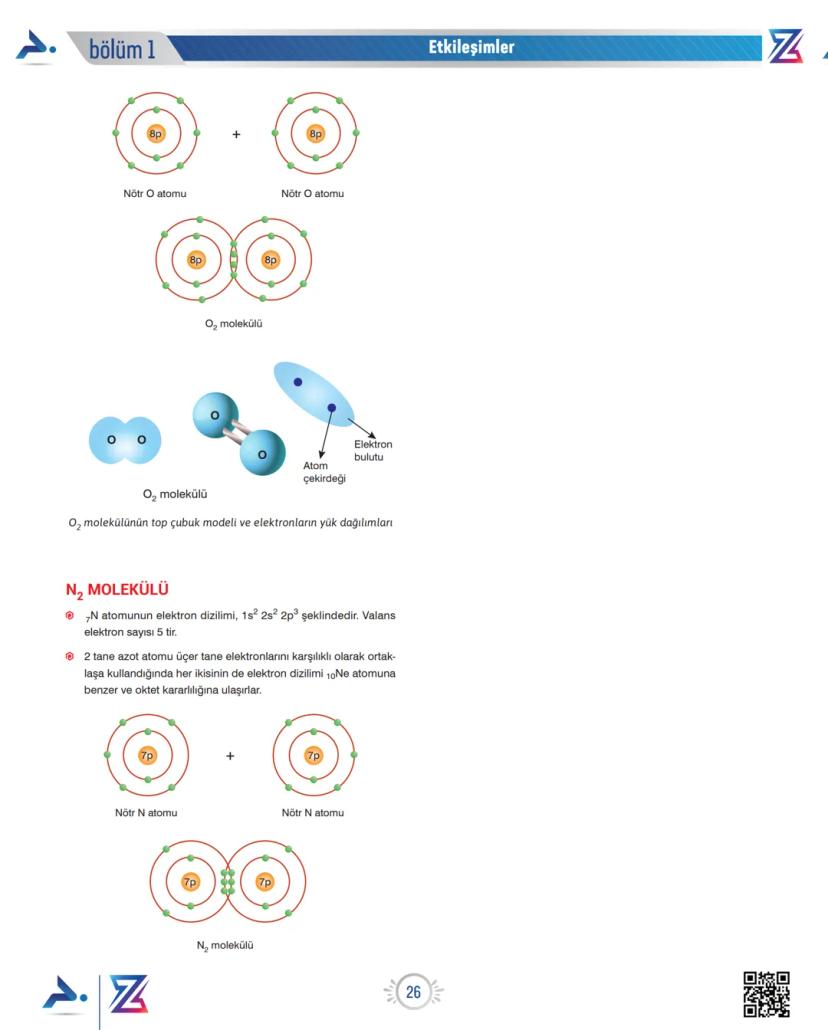
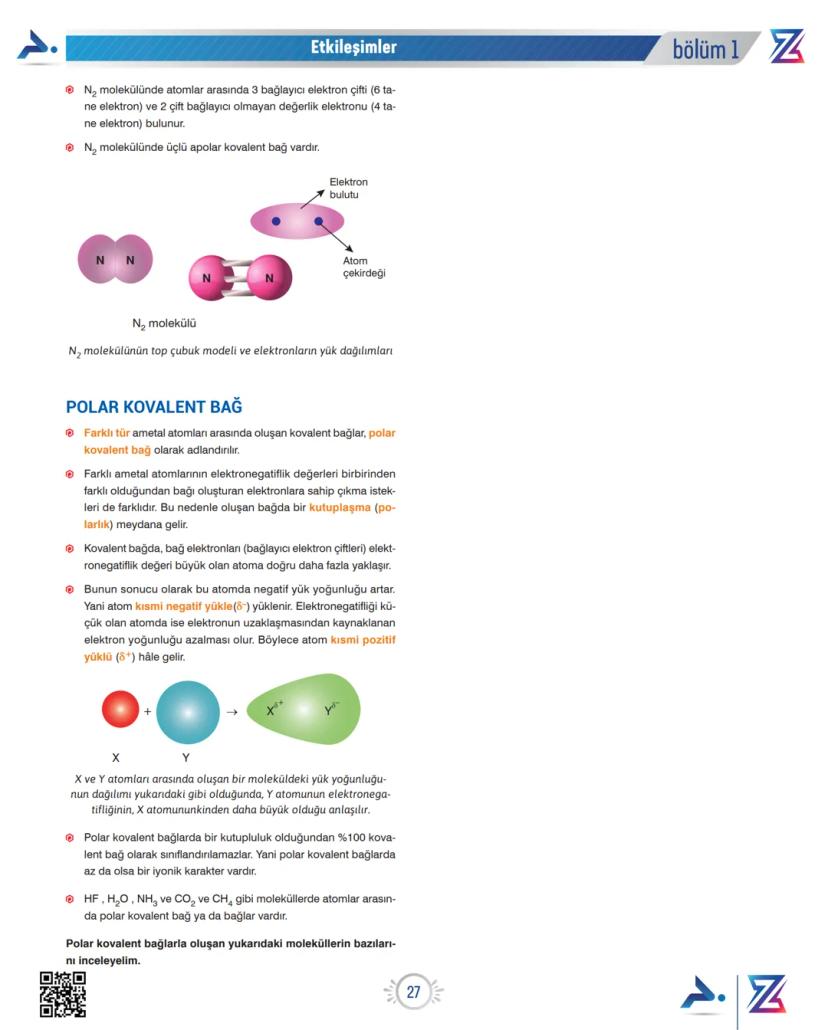
Ametaller (C, H, O, N, S gibi elementler) elektron vermeyi pek sevmezler çünkü yüksek iyonlaşma enerjisi değerlerine sahiptirler. Bu nedenle, birbirleriyle etkileşime girdiklerinde elektron alışverişi yerine elektronlarını ortaklaşa kullanmayı tercih ederler.
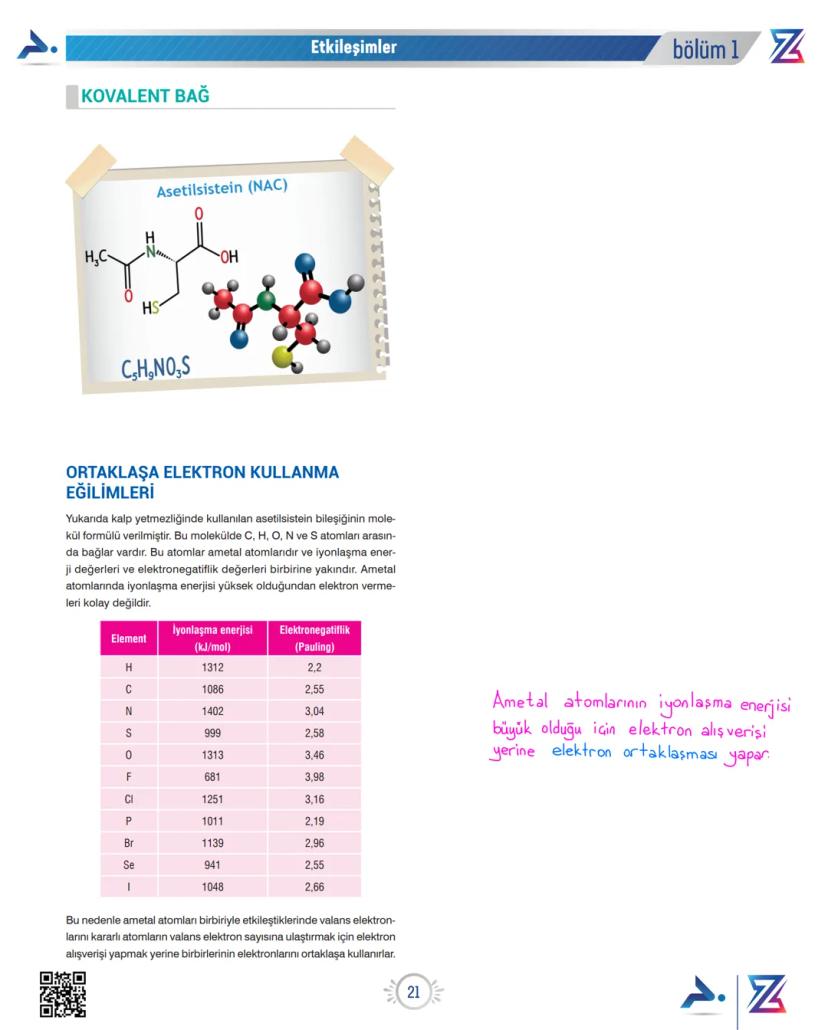
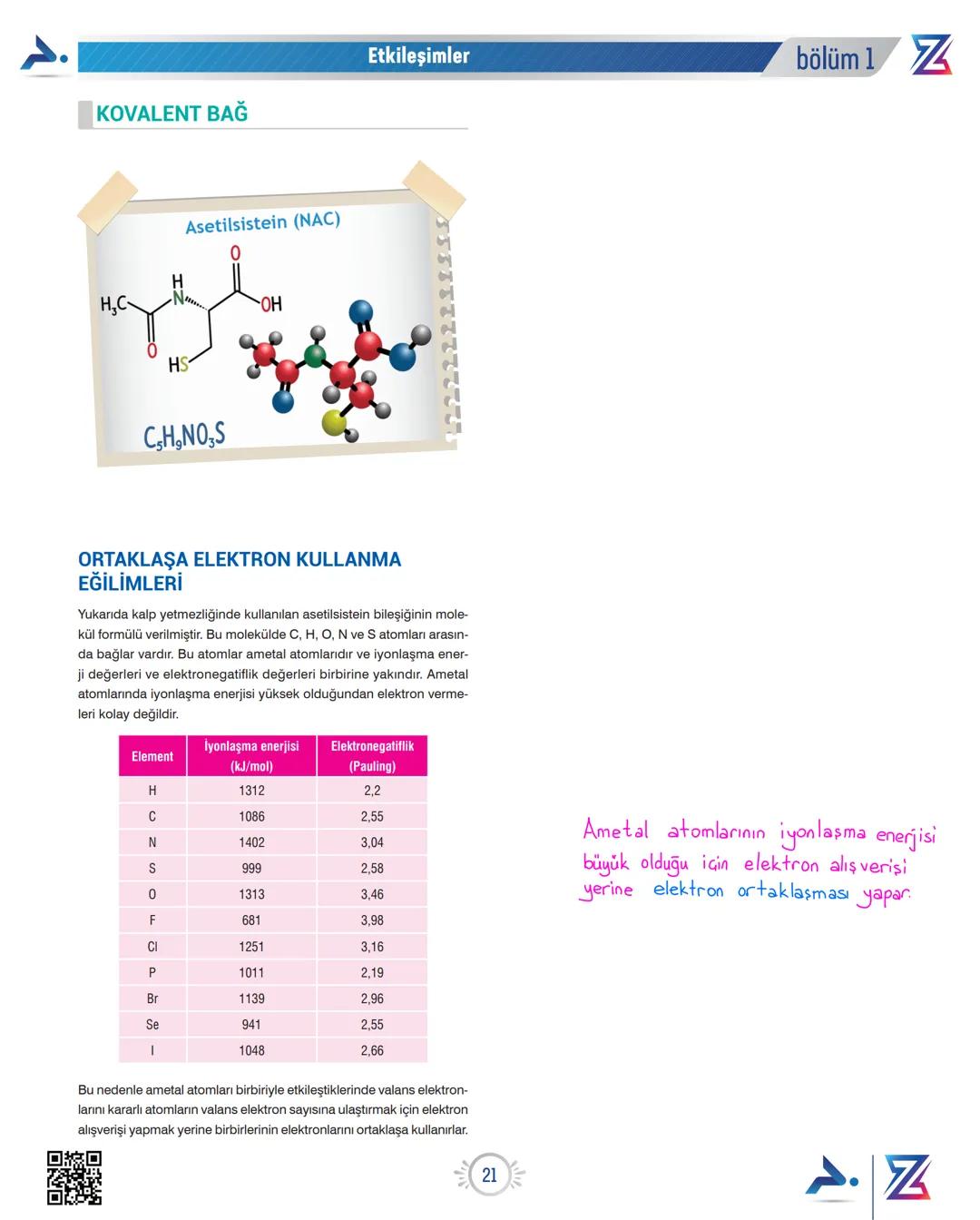
Örneğin kalp yetmezliğinde kullanılan asetilsistein (NAC) molekülünde C, H, O, N ve S atomları arasında kovalent bağlar vardır. Bu elementlerin birbirine yakın elektronegatiflik değerleri, elektronları paylaşarak bağ oluşturmalarını sağlar.
Bunu biliyormuydunuz? Ametal atomları iyonlaşma enerjileri büyük olduğu için elektron alışverişi yapmak yerine elektronları ortaklaşa kullanırlar.
Kovalent bağlarda atomlar, kararlı bir elektron dizilimine ulaşmak için elektronlarını paylaşırlar. Bu paylaşım, hem element moleküllerinde (örneğin H₂) hem de bileşik moleküllerinde (örneğin H₂O) gerçekleşir.