Orbital Kuralları
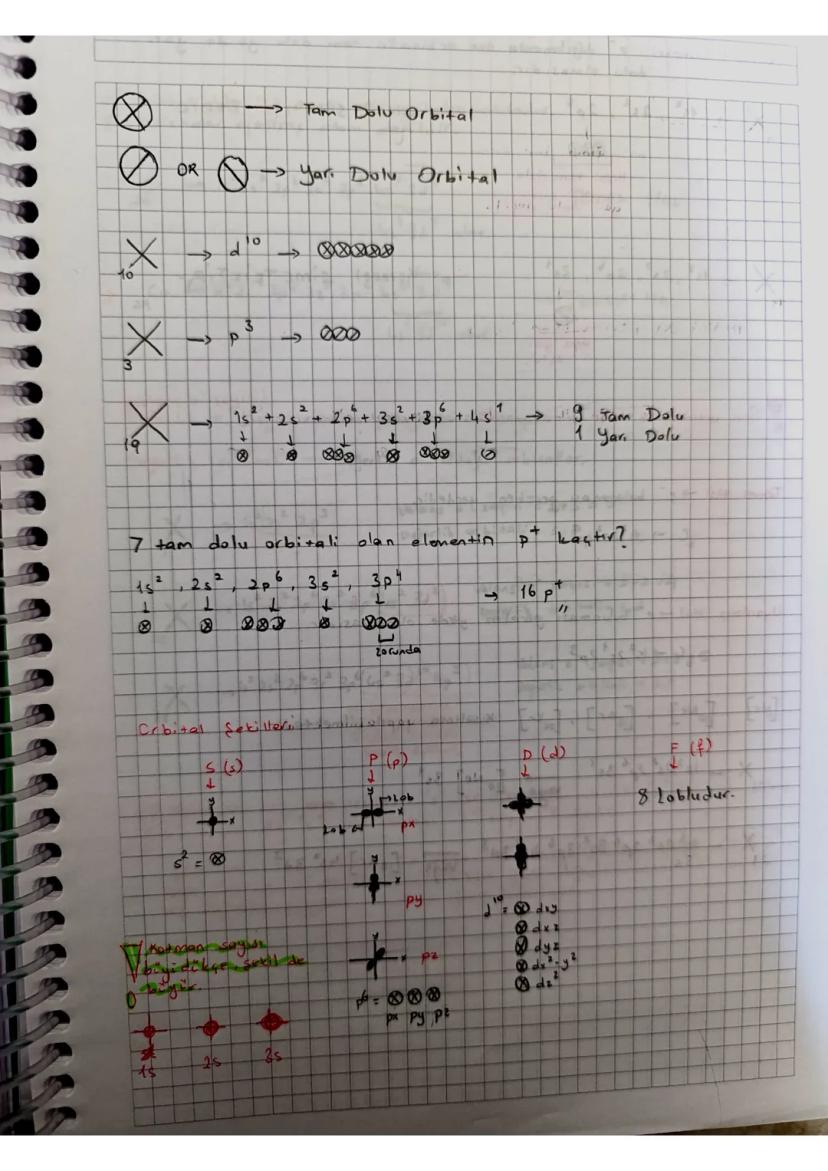
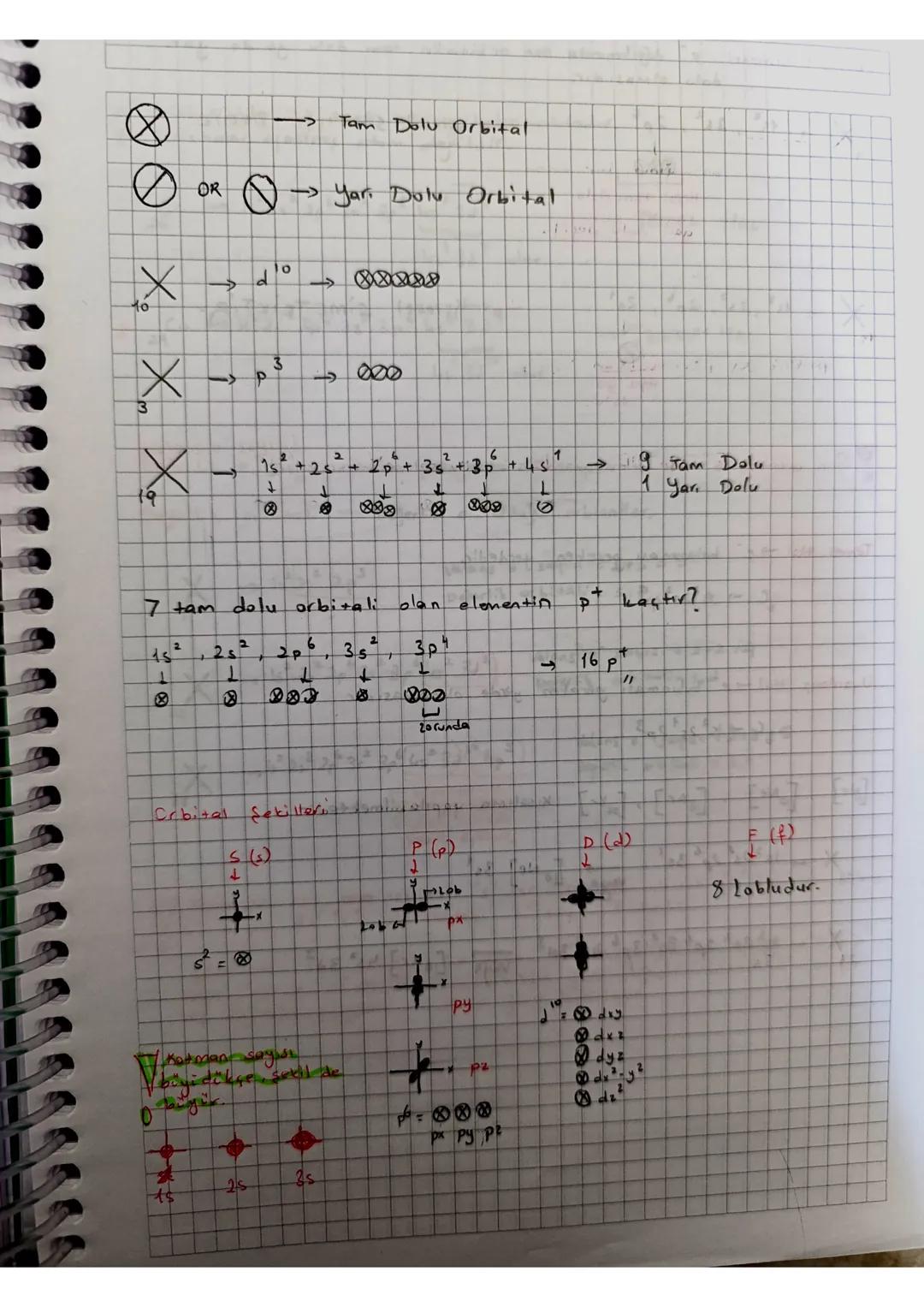
Pauli Kuralı: Bir orbitale en fazla zıt spinli iki elektron yerleştirilebilir (↑↓). Okların yönü zıt olduğu sürece yukarı veya aşağı bakmasının önemi yoktur. Bu kuralla her orbital türünün toplam kapasite hesabı yapılır: s→2e-, p→6e-, d→10e-, f→14e-.
Hund Kuralı: Aynı enerji düzeyindeki orbitallere elektronlar önce tek tek yerleştirilir. Örneğin, p² için doğru gösterim (↑)(↑)(□) şeklindedir, (↑↓)(□)(□) şeklinde değildir. Elektronlar paralel spinle (aynı yönde) yerleştirilir.
Aufbau Kuralı: Elektronlar orbitallere en düşük enerjiden en yüksek enerjiye doğru yerleştirilir. Enerji düzeyi sıralaması şöyledir: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f...
Önemli Not: "Yüksek katmandaki elektronun enerjisi daha yüksektir" ifadesi YANLIŞTIR! Enerji sıralaması katman sayısı ve orbital türüne göre değişir.