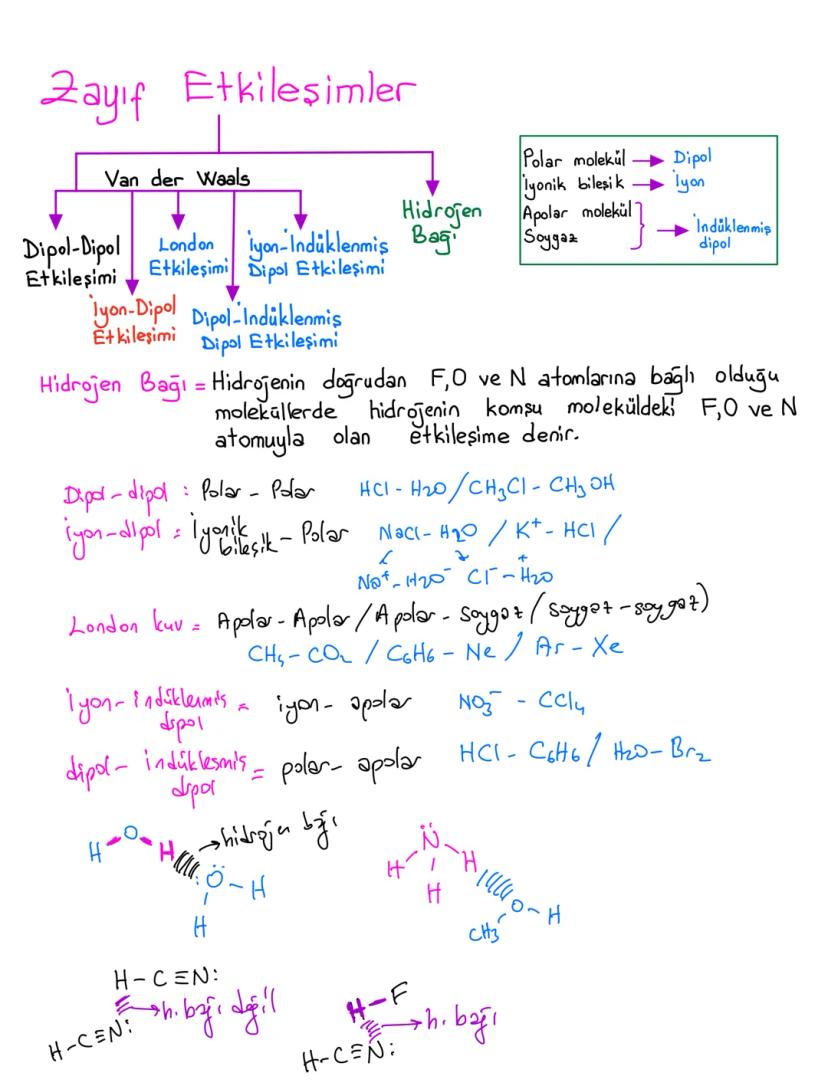
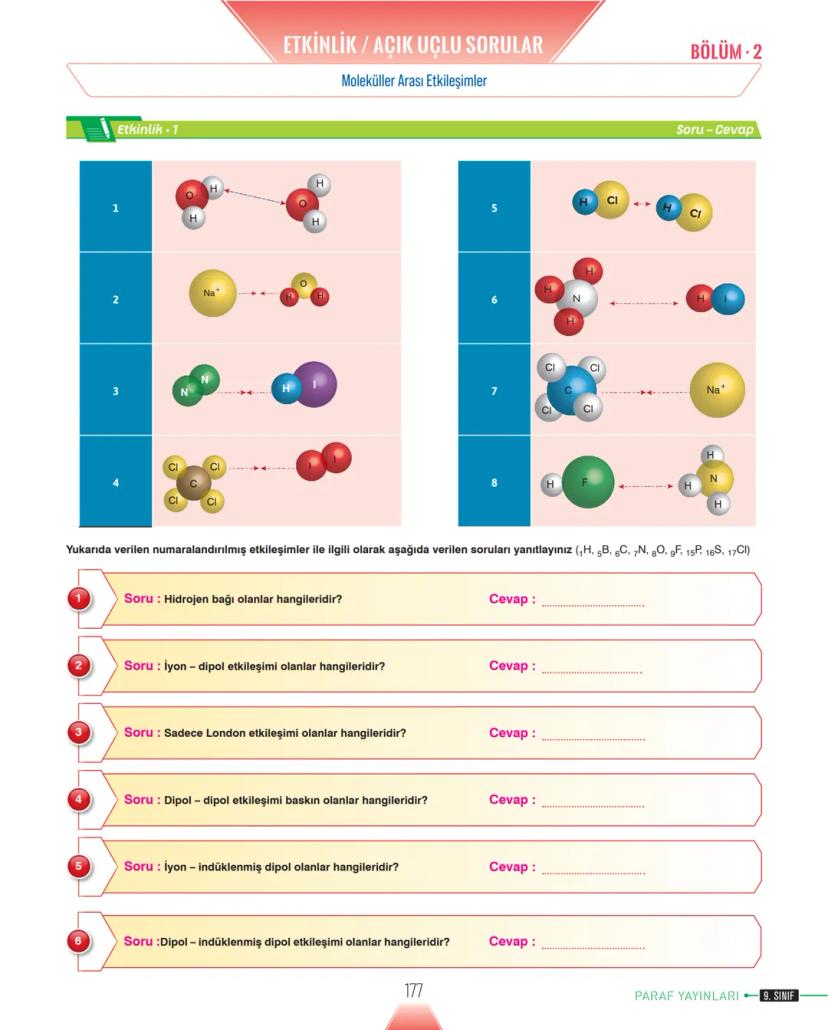
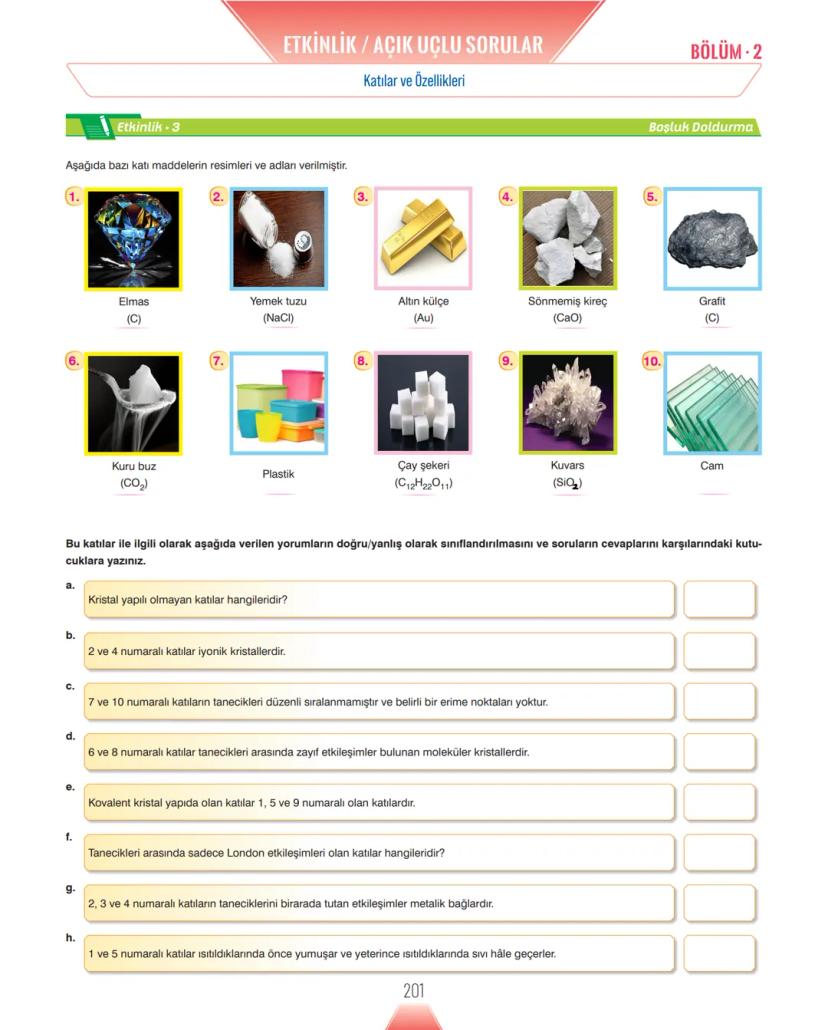
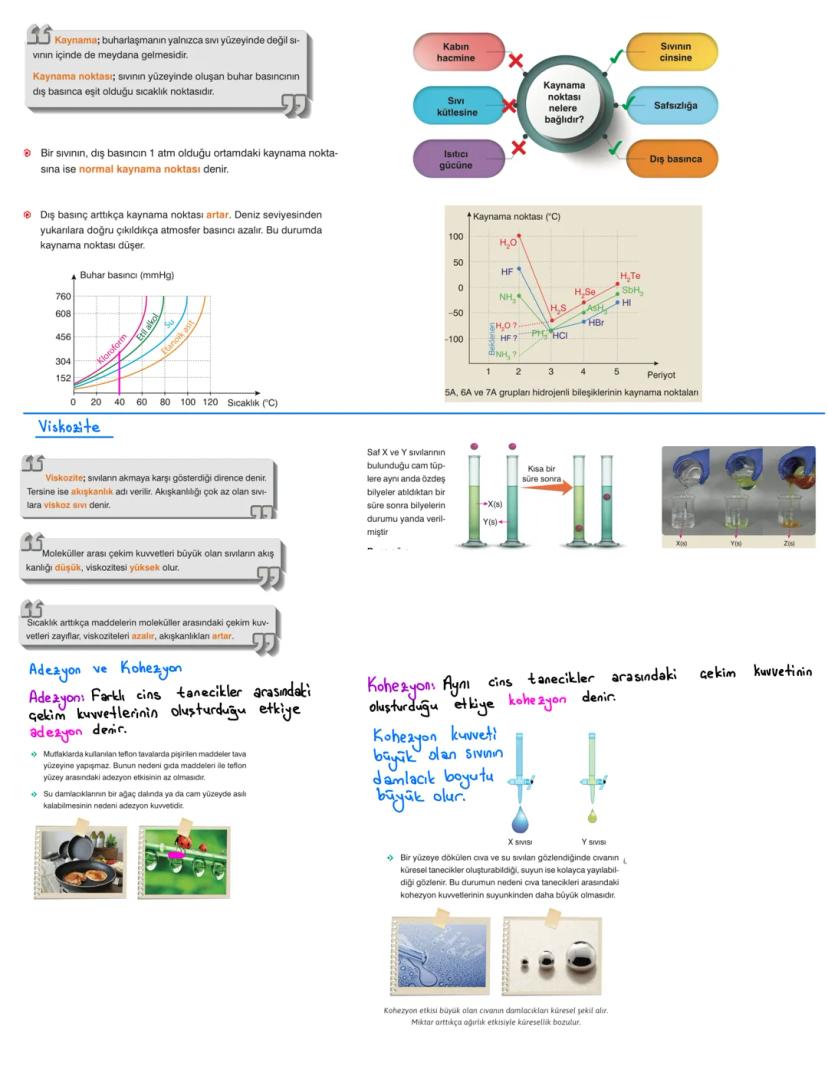
Nanoteknoloji ve Gelecek
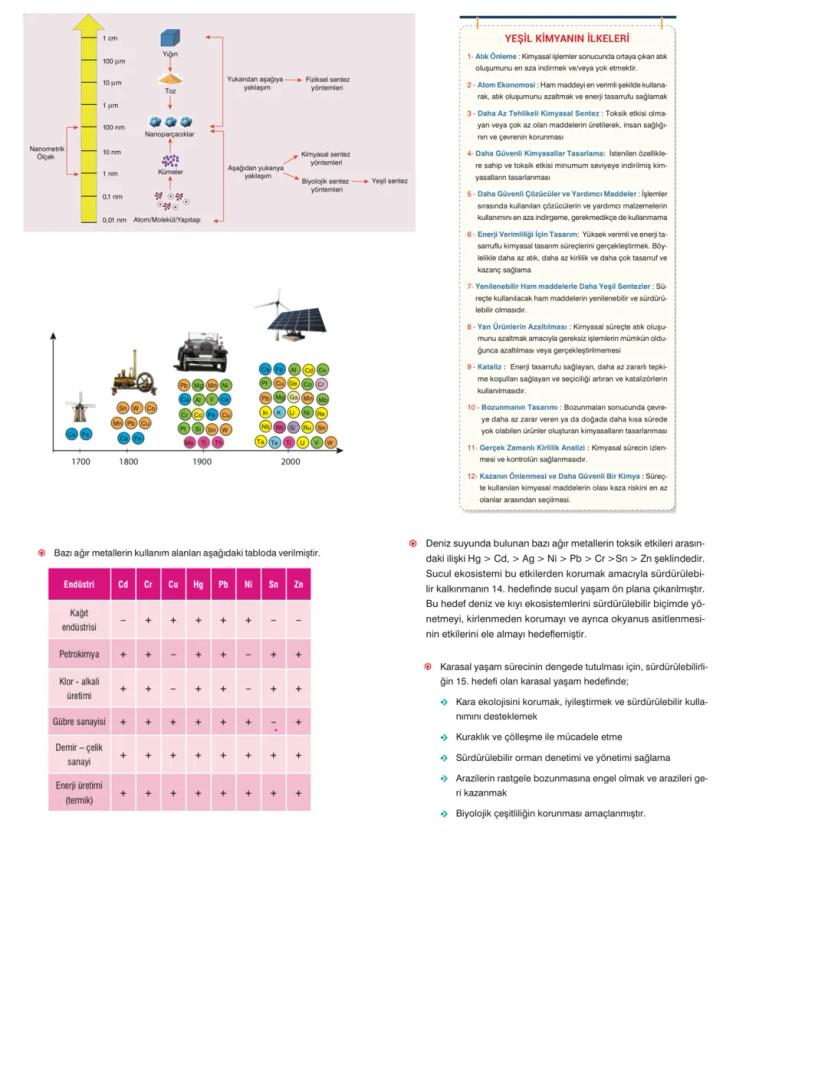
Nanometre milyarda bir metre demektir (10⁻⁹ m). Bu boyut o kadar küçük ki DNA molekülü bile sadece 2-3 nanometre uzunluğunda!
Saç telinin kalınlığı 80.000 nanometre iken, grip virüsü sadece 20 nanometre çapındadır. Bu ölçek farkını kavramak nanoteknolojinin ne kadar ince detaylarla çalıştığını gösterir.
Taramalı elektron mikroskobu (SEM) nanoboyuttaki nesneleri görüntüleyebilen tek araçtır. Çıplak gözle sadece 0,1 mm'lik nesneleri, ışık mikroskobuyla 1 mikrometrelik nesneleri görebiliriz.
Madde nanoboyuta indirildiğinde sadece fiziksel değil, kimyasal özellikleri de değişir. Renk, erime hızı, tepkime verme isteği gibi özellikler tamamen farklılaşabilir.
Bu özellik değişimi nanoteknolojinin sihirli tarafıdır. Aynı element farklı boyutlarda tamamen farklı davranışlar sergileyebilir, bu da sonsuz uygulama alanı yaratır.
Şaşırtıcı Gerçek: Yüzey alanı/hacim oranı arttıkça maddenin fiziksel ve kimyasal özellikleri kökten değişir!