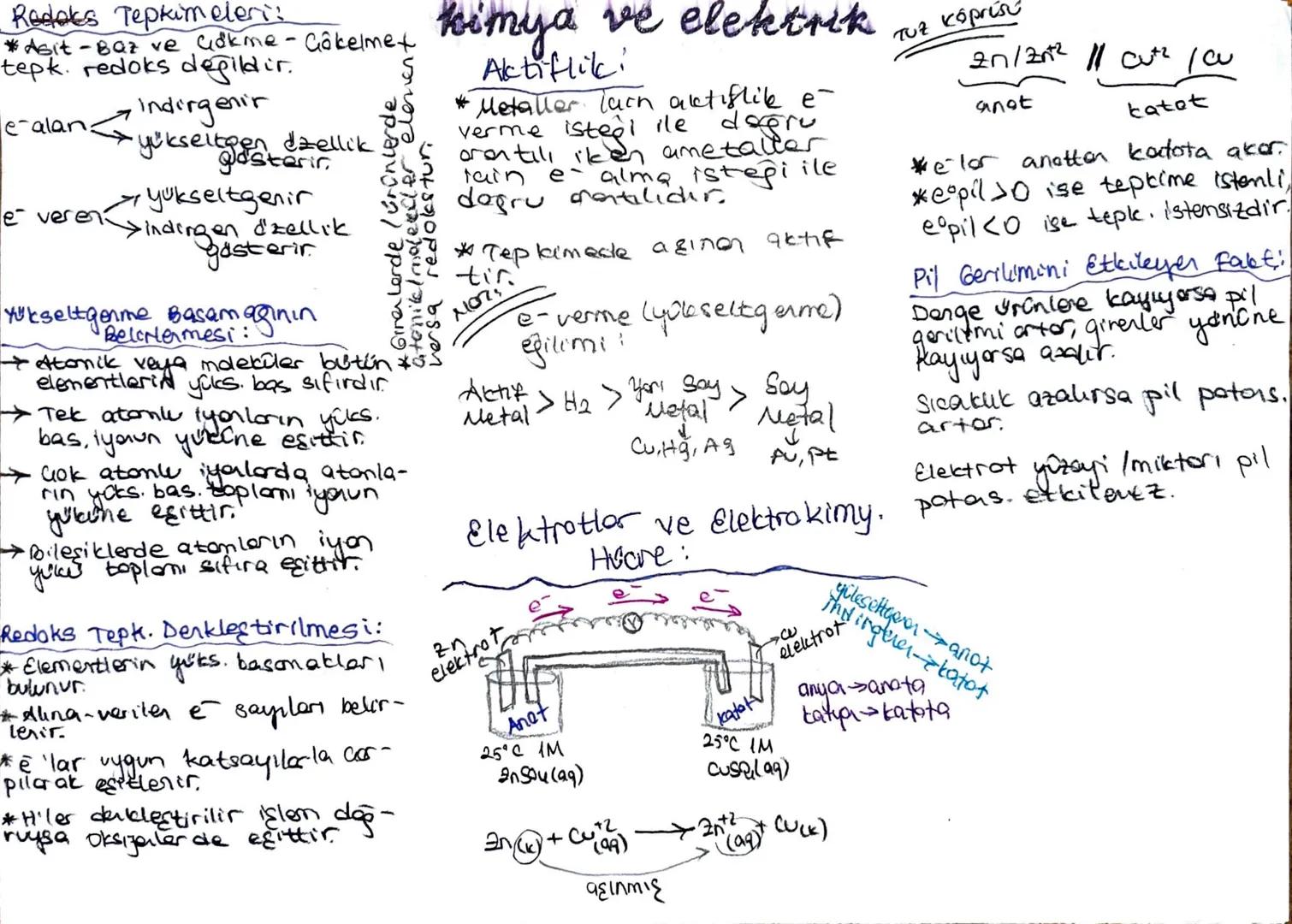
Redoks Tepkimeleri ve Elektrokimya
Redoks tepkimeleri, elektron transferi ile gerçekleşen kimyasal değişimlerdir. Bu tepkimelerde, elektron alan madde yükseltgen özellik gösterirken, elektron veren madde ise indirgen özellik gösterir. Asit-baz tepkimeleri ve çökelme tepkimeleri redoks tepkimesi değildir.
Yükseltgenme basamağı kavramı, redoks tepkimelerini anlamak için çok önemlidir. Atomik veya moleküler elementlerin yükseltgenme basamağı sıfırdır. Tek atomlu iyonların yükseltgenme basamağı iyonun yüküne eşittir. Çok atomlu iyonlarda atom yüklerinin toplamı iyon yüküne, bileşiklerde ise atom yüklerinin toplamı sıfıra eşittir.
Metallerin aktiflik sıralaması, elektron verme istekleriyle doğru orantılıdır: Aktif metaller > H₂ > Yarı soy metaller > Soy metaller. Elektron verme eğilimi yüksek olan metaller (aktif metaller) daha kolay yükseltgenirken, soy metaller (Cu, Hg, Ag, Au, Pt) elektron vermeye daha az eğilimlidir.
Hatırlatıcı Not: Bir galvanik pilde elektronlar her zaman anottan katota doğru akar. Eğer pil gerilimi pozitifse (Epil > 0) tepkime kendiliğinden gerçekleşir, negatifse (Epil < 0) gerçekleşmez.
Redoks tepkimelerini denkleştirirken önce elementlerin yükseltgenme basamakları bulunur, alınan-verilen elektron sayıları belirlenir ve uygun katsayılarla çarpılarak eşitlenir. Pil gerilimini etkileyen faktörler arasında sıcaklık, elektrot yüzeyi/miktarı ve denge durumu bulunur.