Gazların Temel Özellikleri ve Gaz Yasaları
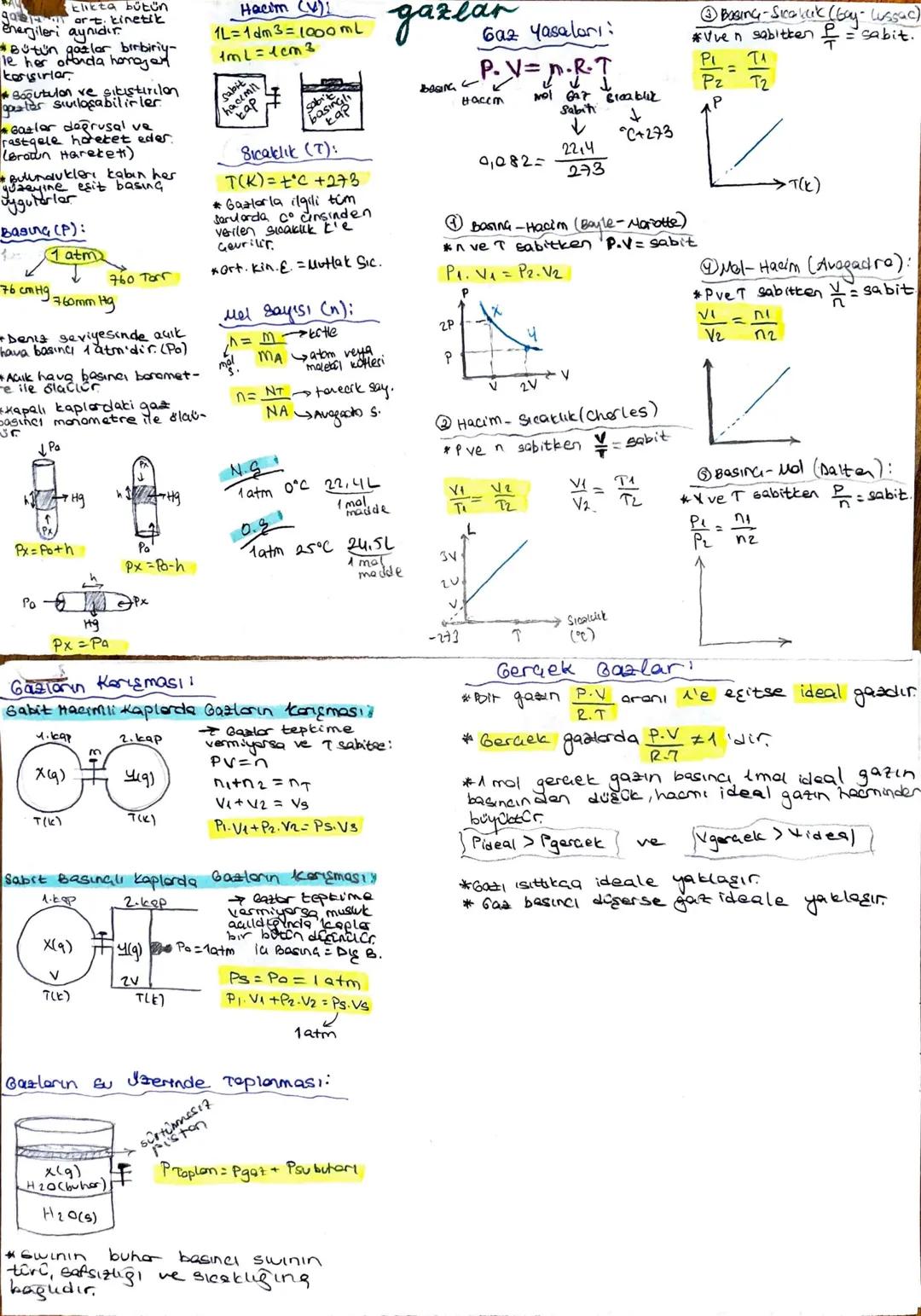
Gazlar sürekli ve rastgele hareket eden taneciklerden oluşur. Aynı sıcaklıkta tüm gazların ortalama kinetik enerjileri eşittir ve bulundukları kabın her yüzeyine eşit basınç uygularlar. Gazlar sıkıştırılabilir ve soğutulduklarında sıvılaşabilirler.
Gaz basıncı farklı birimlerle ifade edilebilir: 1 atm = 760 Torr = 76 cmHg. Deniz seviyesinde açık hava basıncı 1 atm olup, barometre ile ölçülür. Kapalı kaplardaki gaz basıncı ise manometre ile ölçülür. Gazlarla ilgili hesaplamalarda sıcaklık mutlaka Kelvin birimine T(K)=°C+273 çevrilmelidir.
Gazlar dört temel yasa ile tanımlanır. Boyle-Mariotte Yasası'na göre, sıcaklık ve mol sayısı sabitken basınç-hacim çarpımı sabittir P1V1=P2V2. Gay-Lussac Yasası'nda hacim ve mol sabitken basınç-sıcaklık oranı sabittir P1/T1=P2/T2. Charles Yasası'na göre, basınç ve mol sabitken hacim-sıcaklık oranı sabittir V1/T1=V2/T2. Avogadro Yasası ise basınç ve sıcaklık sabitken hacim-mol oranının sabit olduğunu belirtir V1/n1=V2/n2.
Dikkat! İdeal gaz denklemi PV = nRT ile ifade edilir ve gerçek gazlar yüksek sıcaklıkta veya düşük basınçta ideal gaza yaklaşır. Gerçek gazlarda P·V/(R·T) oranı 1'e eşit değildir.
Gazlar kapalı kaplarda karıştırıldığında, tepkime vermiyorlarsa toplam basınç kısmi basınçların toplamına eşittir. Gazların su üzerinde toplandığı durumlarda ise, toplam basınç gaz basıncı ile suyun buhar basıncının toplamına eşittir Ptoplam=Pgaz+Psubuharı.