Atomun Kuantum Modeli
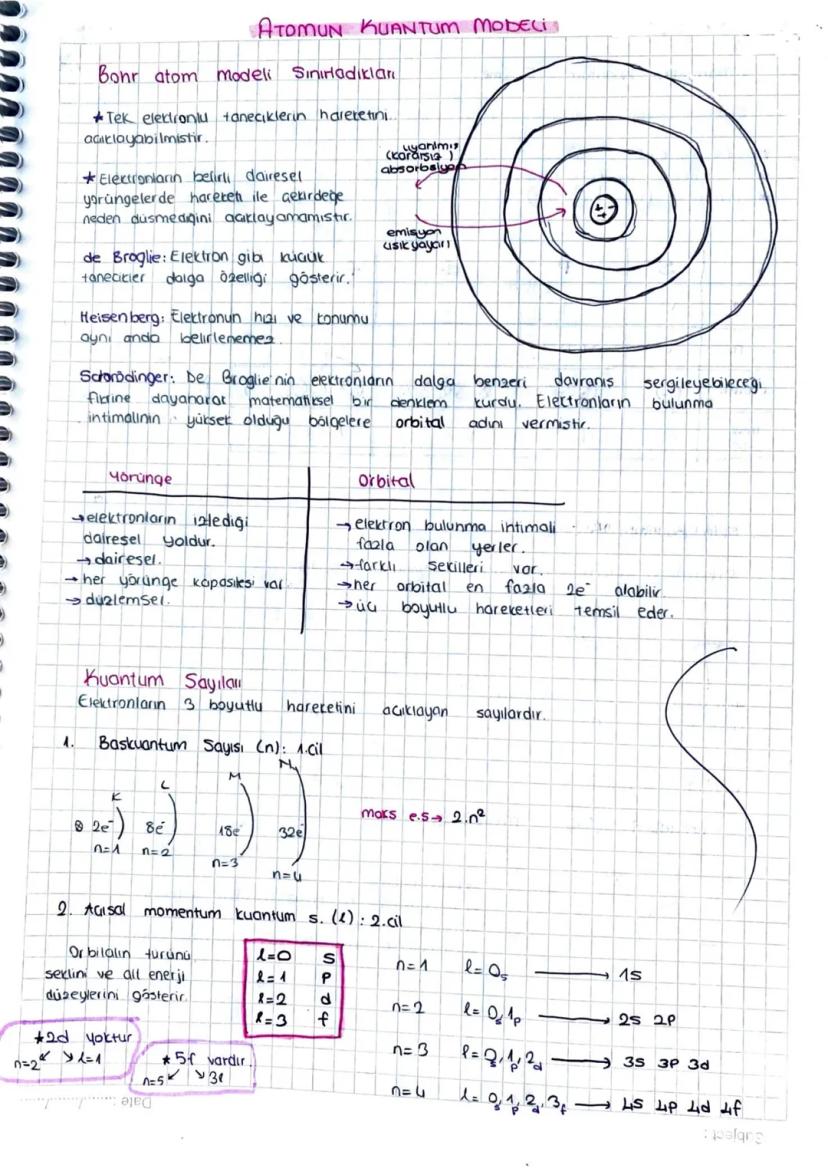
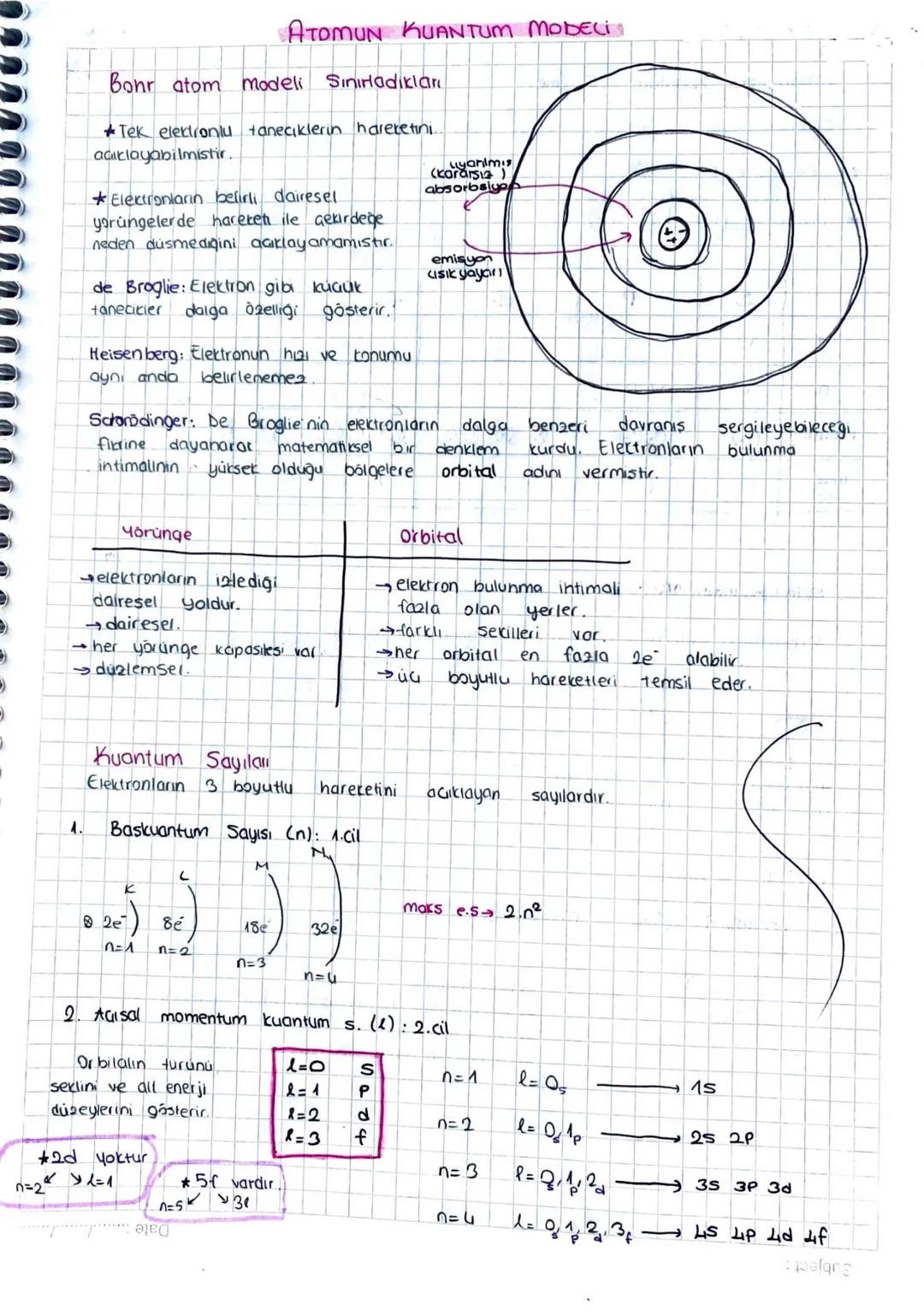
Bohr atom modelinin sınırları vardı çünkü sadece tek elektronlu tanecikleri açıklayabiliyordu. Elektronların neden çekirdeğe düşmediğini tam olarak açıklayamıyordu.
de Broglie elektron gibi küçük taneciklerin dalga özelliği gösterdiğini keşfetti. Heisenberg ise elektronun hızı ve konumunu aynı anda belirlemenin imkansız olduğunu ortaya koydu.
Schrödinger bu fikirlere dayanarak matematiksel bir denklem kurdu ve elektronların bulunma ihtimalinin yüksek olduğu bölgelere orbital adını verdi. Orbital kavramı yörüngeden farklıdır - yörüngeler dairesel yollarken, orbitaller farklı şekillerde üç boyutlu bölgelerdir.
Önemli: Her orbital en fazla 2 elektron alabilir!
Kuantum Sayıları
Kuantum sayıları elektronların üç boyutlu hareketini açıklayan dört farklı sayıdır. Her elektronun kendine özgü bir adresi gibi düşünebilirsin.
Baş kuantum sayısı (n) enerji seviyesini gösterir. n=1,2,3,4 değerlerini alır ve sırasıyla K,L,M,N katmanlarına karşılık gelir. Her katmandaki maksimum elektron sayısı 2n² formülüyle hesaplanır.
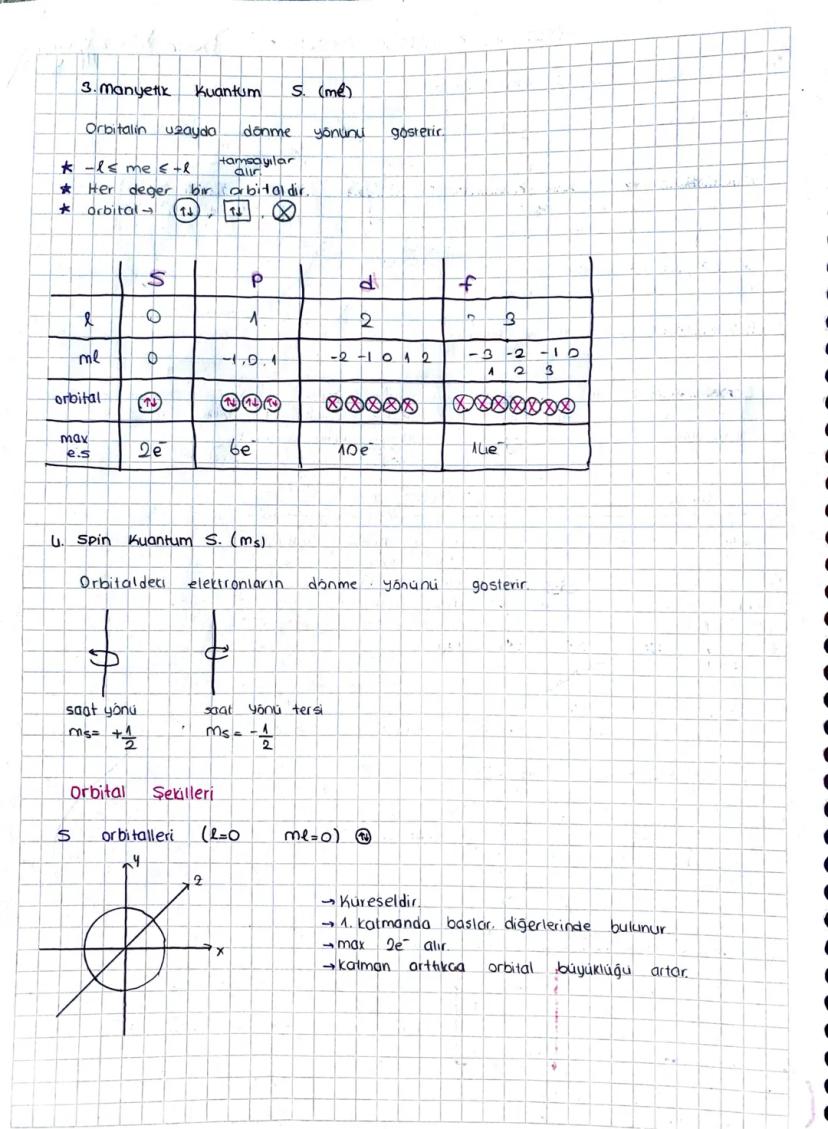
Azimutal momentum kuantum sayısı (l) orbitalin şeklini belirler. l=0,1,2,3 değerleri sırasıyla s,p,d,f orbitallerine karşılık gelir. Her n değeri için l, 0'dan n−1'e kadar değer alabilir.