Atomun Kuantum Modeli ve Kuantum Sayıları
Atomdaki elektronları tam olarak anlayabilmek için dört kuantum sayısını bilmen gerekiyor. Bu sayılar elektronların adeta kimlik kartı gibi işlev görür.
Baş kuantum sayısı (n), elektronun hangi enerji seviyesinde olduğunu gösterir. n = 1, 2, 3, 4... şeklinde artar ve sayı büyüdükçe elektron çekirdekten uzaklaşır.
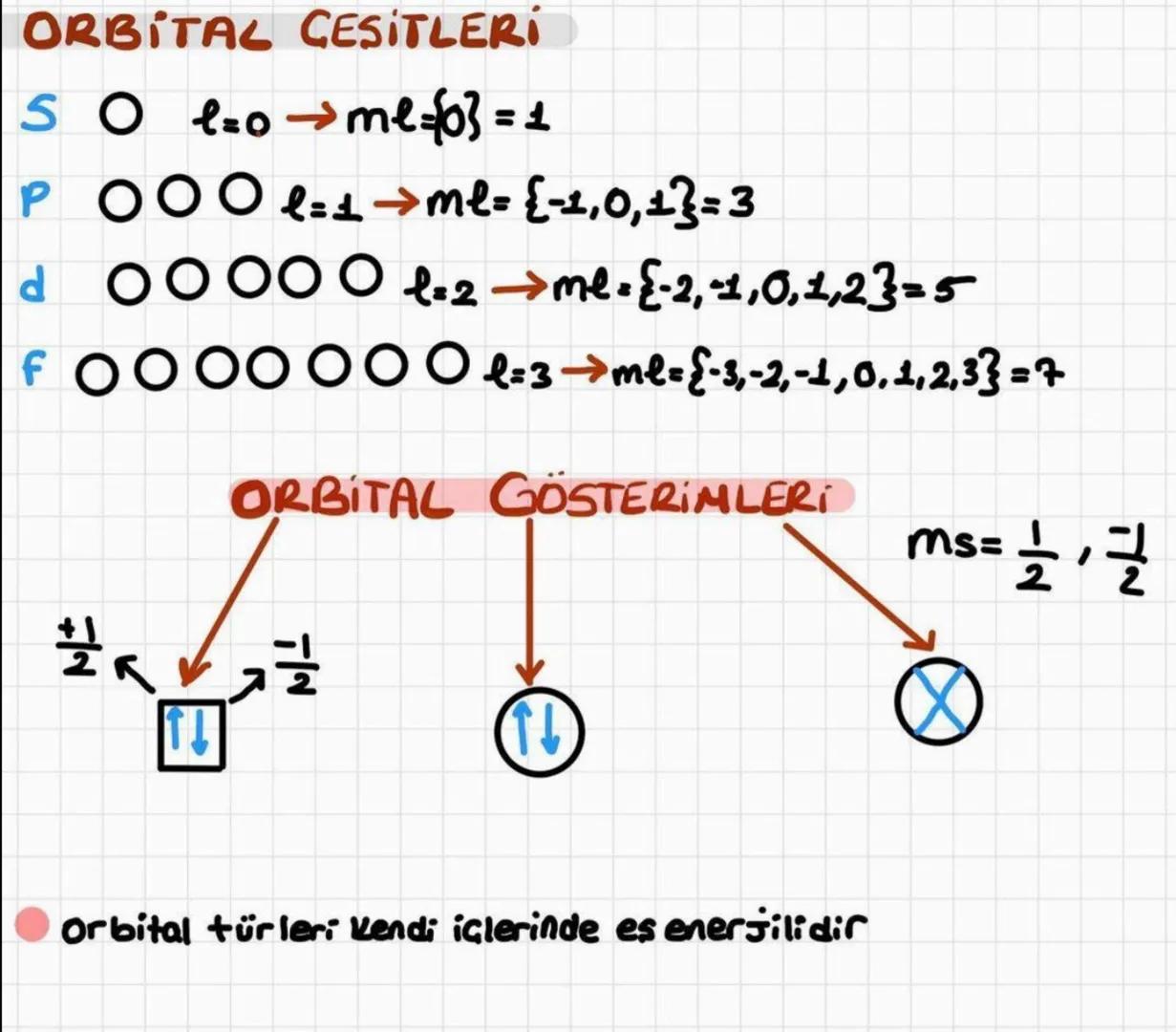
Açısal momentum kuantum sayısı (l), orbitallerin şeklini belirler. 0'dan n−1'e kadar değer alır: l=0 için s orbitali, l=1 için p orbitali, l=2 için d orbitali ve l=3 için f orbitali oluşur.
Manyetik kuantum sayısı (ml) orbitallerin uzaydaki yönelimini açıklar ve -l ile +l arasında değerler alır. Spin kuantum sayısı (ms) ise elektronların dönme yönünü belirtir ve sadece +1/2 veya -1/2 değerlerini alabilir.
💡 Hatırla: Her elektron bu dört kuantum sayısıyla benzersiz bir kimlik kazanır!