Atom Modelleri ve Tarihsel Gelişimi
Atom modelleri tarih boyunca sürekli gelişmiştir. Her model, atomun yapısını daha iyi açıklamak için önceki modellerin eksikliklerini gidermeye çalışmıştır. Democritos'tan Modern Atom Modeli'ne kadar uzanan bu yolculuk, bilimin nasıl ilerlediğini gösterir.
Dalton Atom Modeli (1803) kimyada modern çağın başlangıcı kabul edilir. Bu modele göre elementler bölünemez atomlardan oluşur, bir elementin tüm atomları aynıdır ve kimyasal tepkimeler atomların yeniden düzenlenmesinden ibarettir.
Thomson Modeli (1902) atomu, içinde artı ve eksi yüklerin homojen dağıldığı nötr bir küre olarak tanımlar. Bu modelde elektronların kütlesinin atomun yanında çok küçük olduğu kabul edilir. Rutherford Modeli (1911) ise atomun çoğunun boş olduğunu ve kütlenin çekirdekte toplandığını göstermiştir.
💡 Atomla ilgili her yeni model, bir öncekinin açıklayamadığı gözlemleri açıklamak için geliştirilmiştir. Bu bilim dünyasında çok yaygın bir ilerleyiş biçimidir!
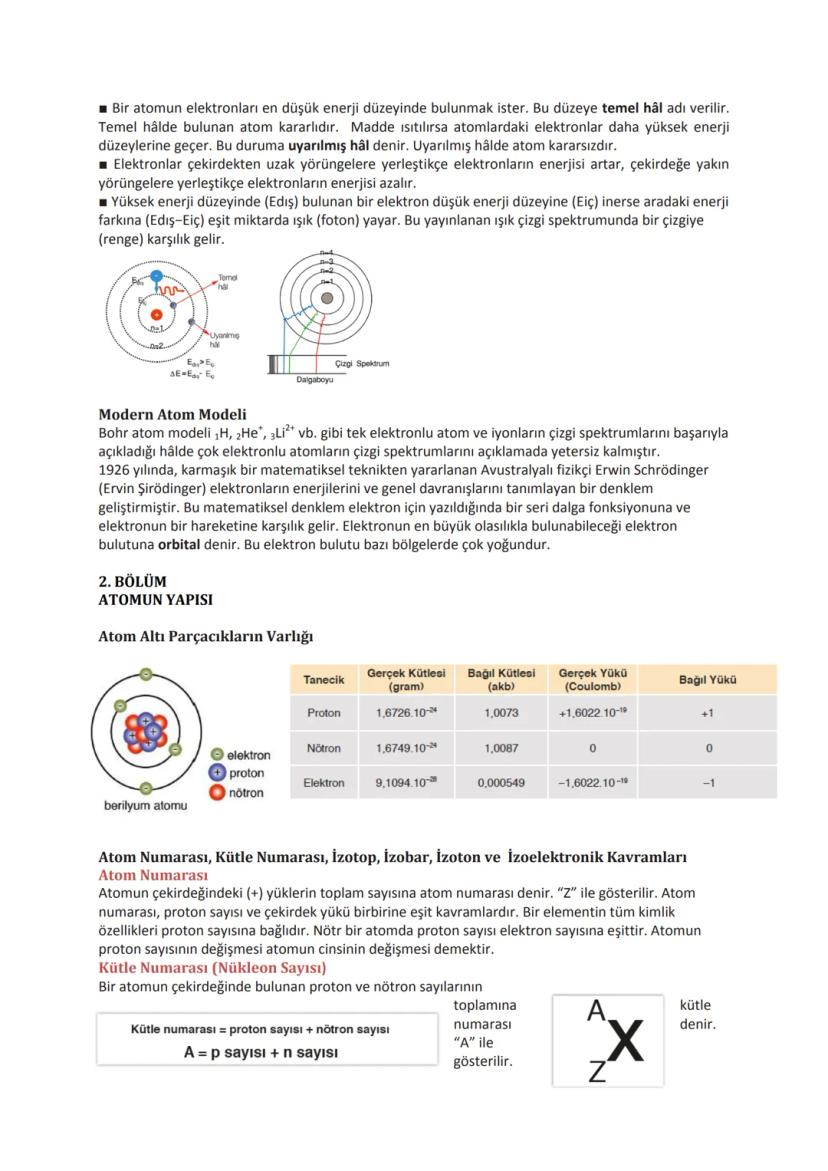
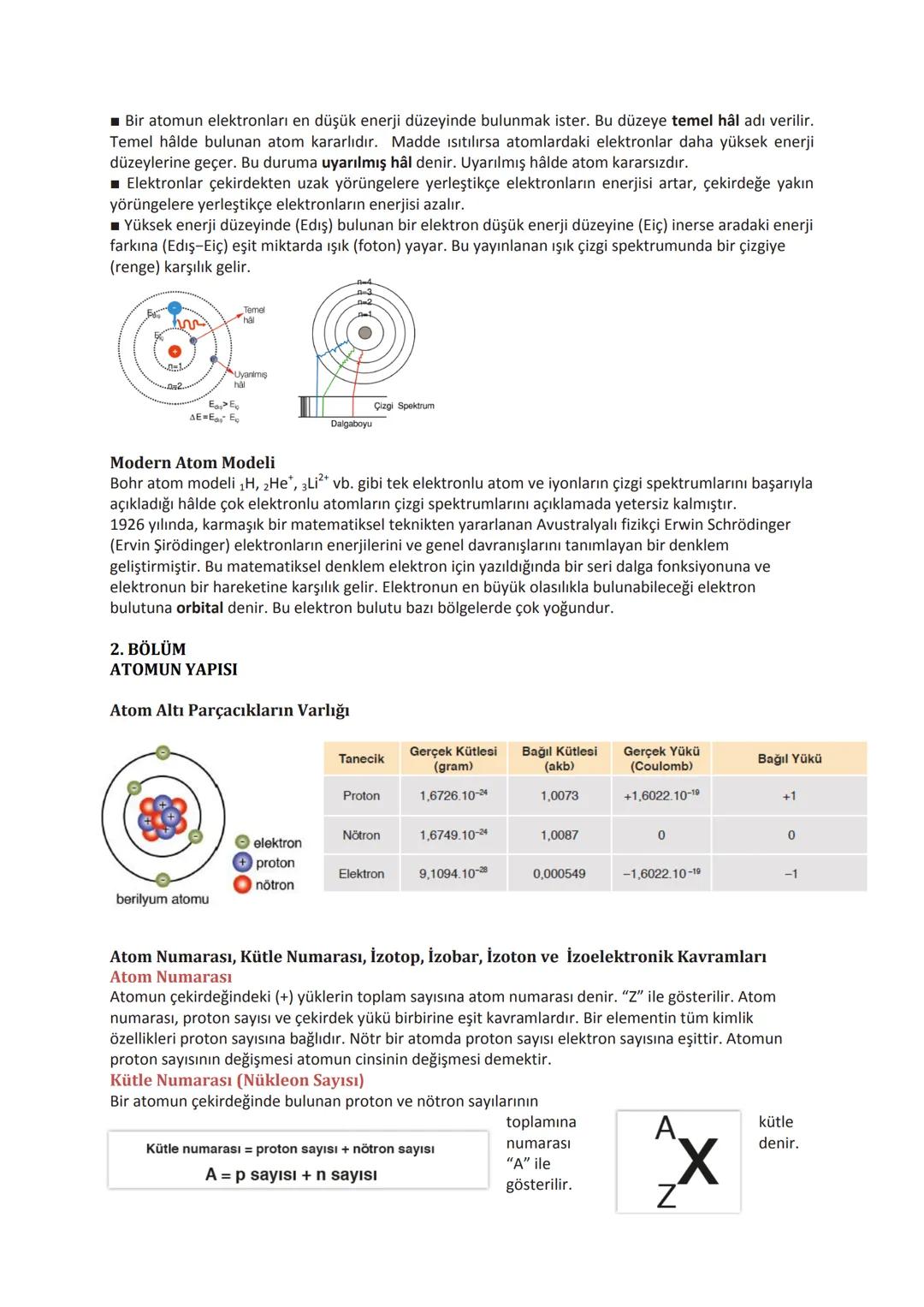
Bohr Atom Modeli (1913) elektronu çekirdeğin etrafında belirli yörüngelerde hareket eden parçacıklar olarak tanımlar. Bu modelde elektronlar K, L, M, N... veyan=1,2,3,4... gibi belirli enerji seviyelerinde bulunur. Elektronun enerjisi, çekirdekten uzaklaştıkça artar.