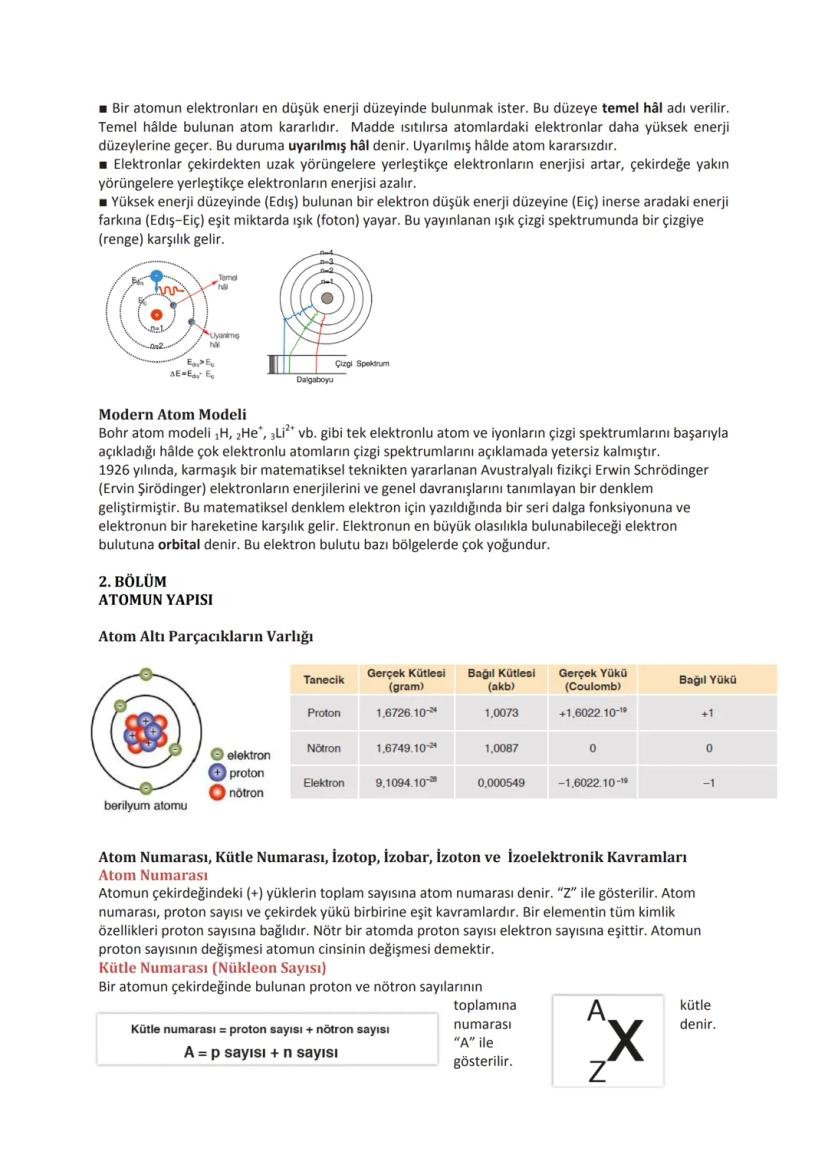
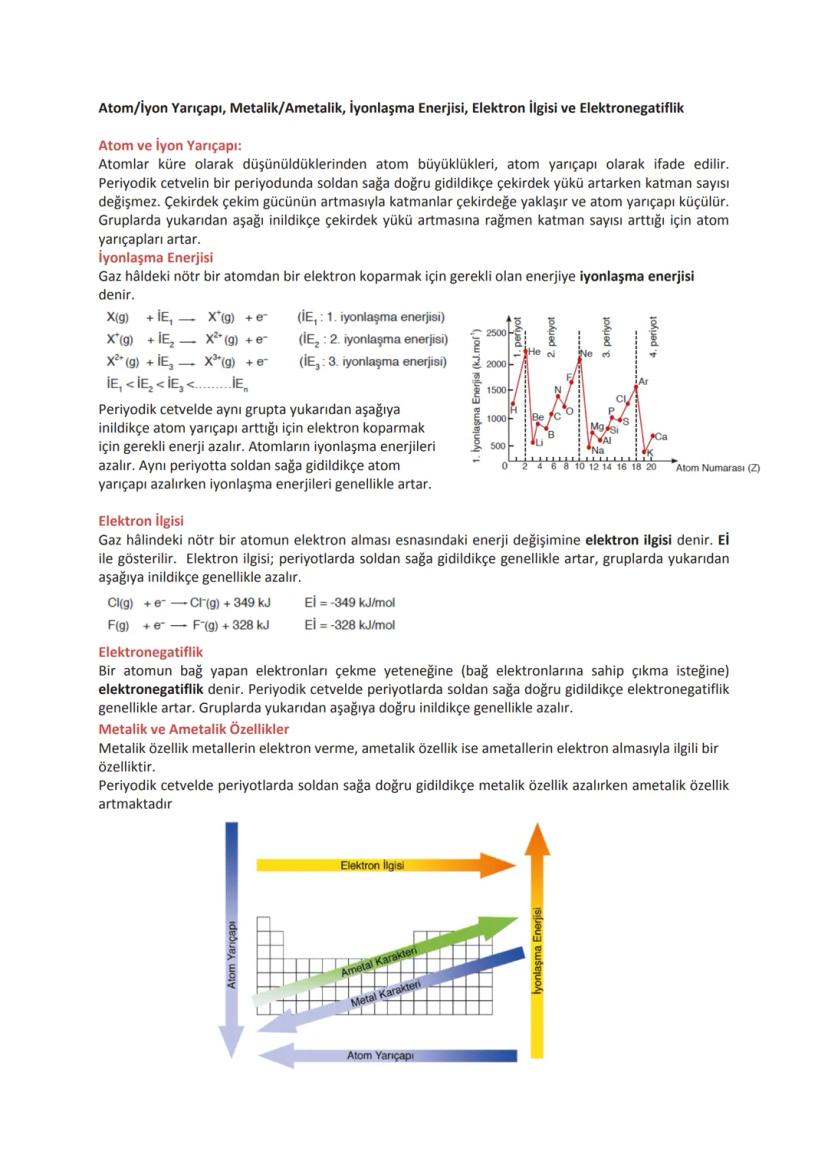
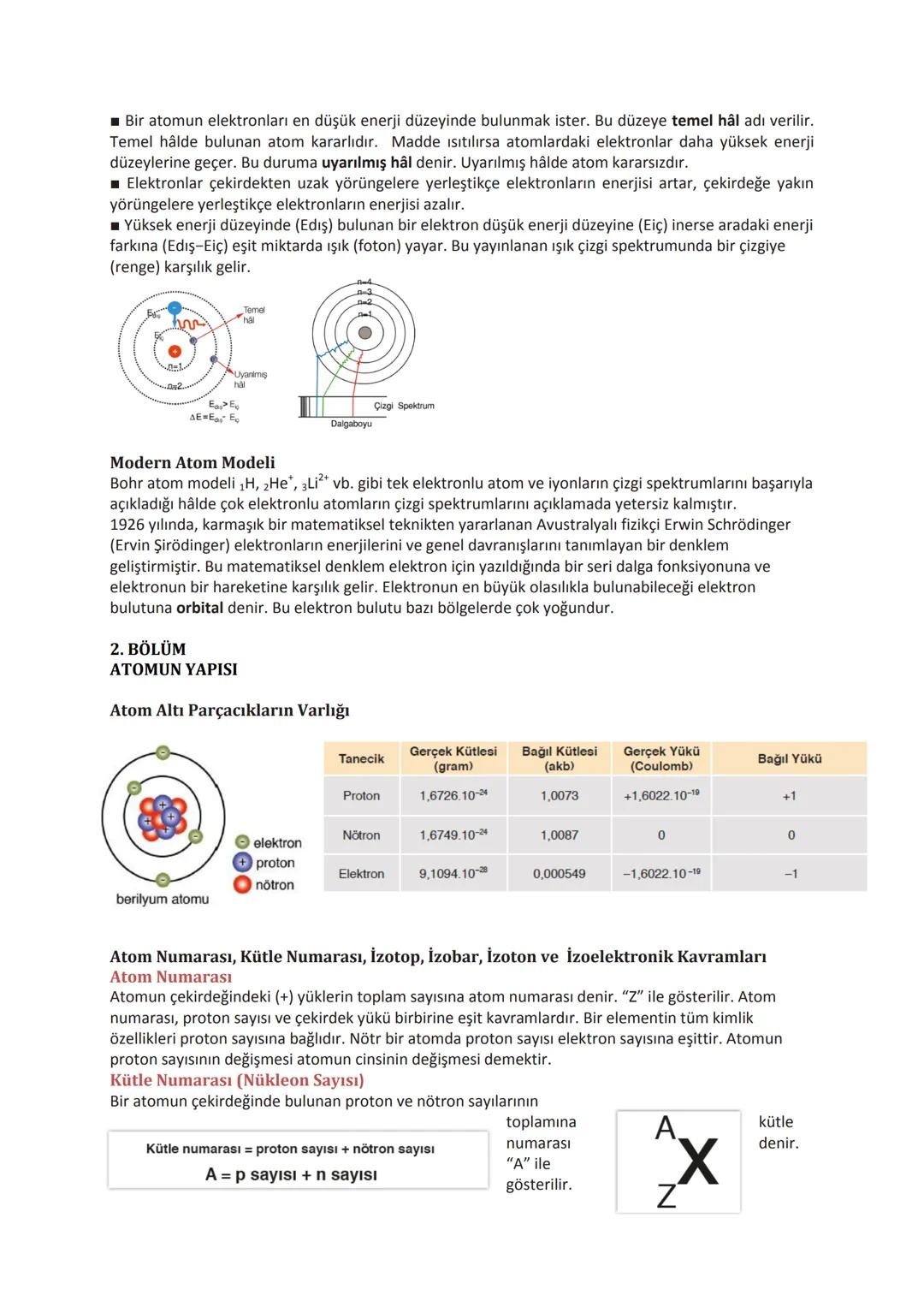
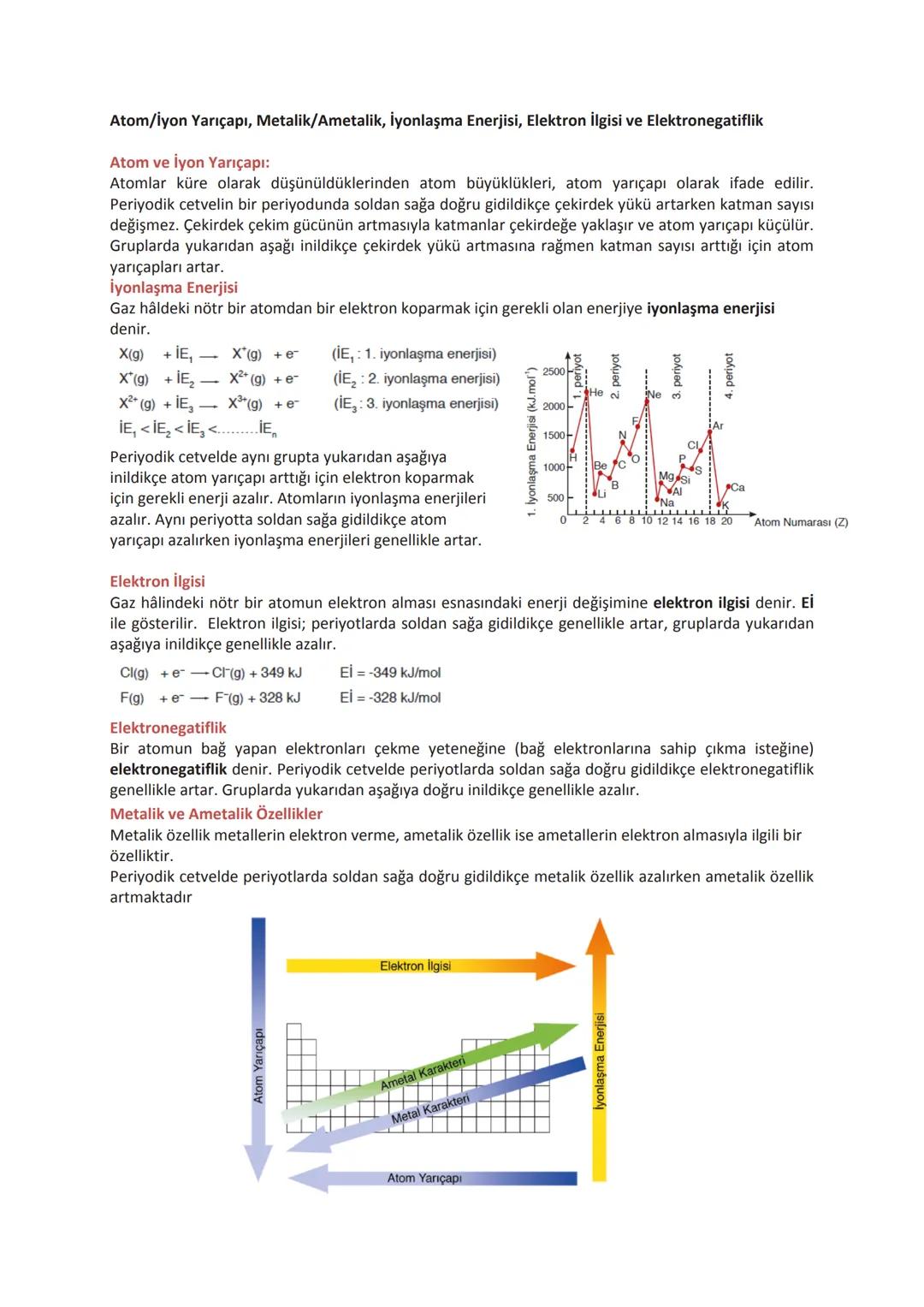
Periyodik Özellikler
Periyodik cetvelde elementler atom numarasına göre sıralandığında bazı özelliklerin düzenli olarak değiştiği görülür. Bu özelliklere periyodik özellikler denir.
Atom yarıçapı, bir periyotta soldan sağa gidildikçe küçülür. Bunun sebebi, çekirdek yükünün artmasıyla elektronların çekirdeğe daha fazla çekilmesidir. Bir grupta yukarıdan aşağıya inildikçe katman sayısı arttığı için atom yarıçapı büyür.
İyonlaşma enerjisi, bir atomdan elektron koparmak için gerekli enerjidir. Periyotta soldan sağa gidildikçe genellikle artar, grupta yukarıdan aşağıya inildikçe azalır. Aynı atomdan ikinci, üçüncü... elektronların koparılması için giderek daha fazla enerji gerekir (IE₁<IE₂<IE₃...).
Elektron ilgisi, bir atomun elektron alması sırasındaki enerji değişimidir. Periyotta soldan sağa gidildikçe genellikle artar, grupta yukarıdan aşağıya inildikçe azalır. Örneğin, klor elementi flor elementinden daha yüksek elektron ilgisine sahiptir.
Elektronegatiflik, atomun bağ elektronlarını çekme yeteneğidir. Periyotta soldan sağa gidildikçe artar, grupta yukarıdan aşağıya inildikçe azalır. Periyodik cetvelde en elektronegatif element fluordur.
Önemli İpucu: Metalik özellik periyodik cetvelde soldan sağa azalır, yukarıdan aşağıya artar. Ametalik özellik ise tam tersi şekilde değişir. Bu trend, elementlerin elektron verme veya alma eğilimleriyle ilgilidir.