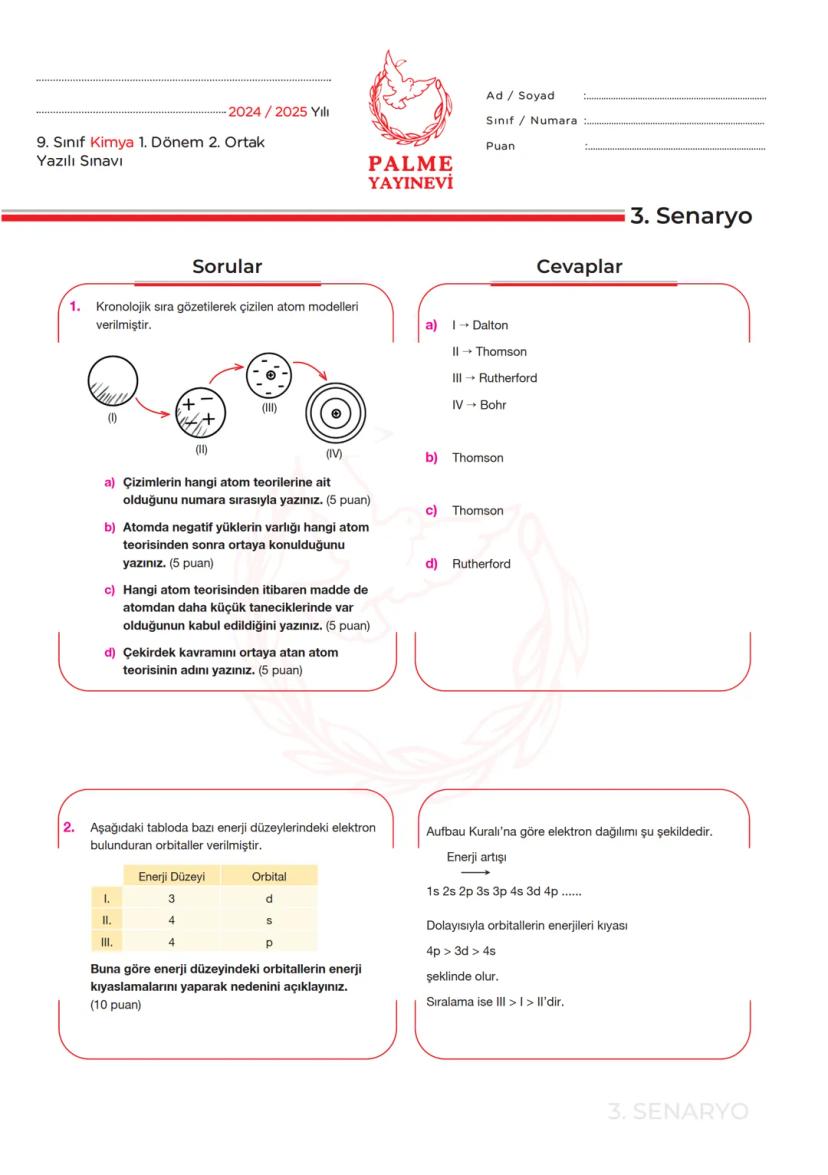
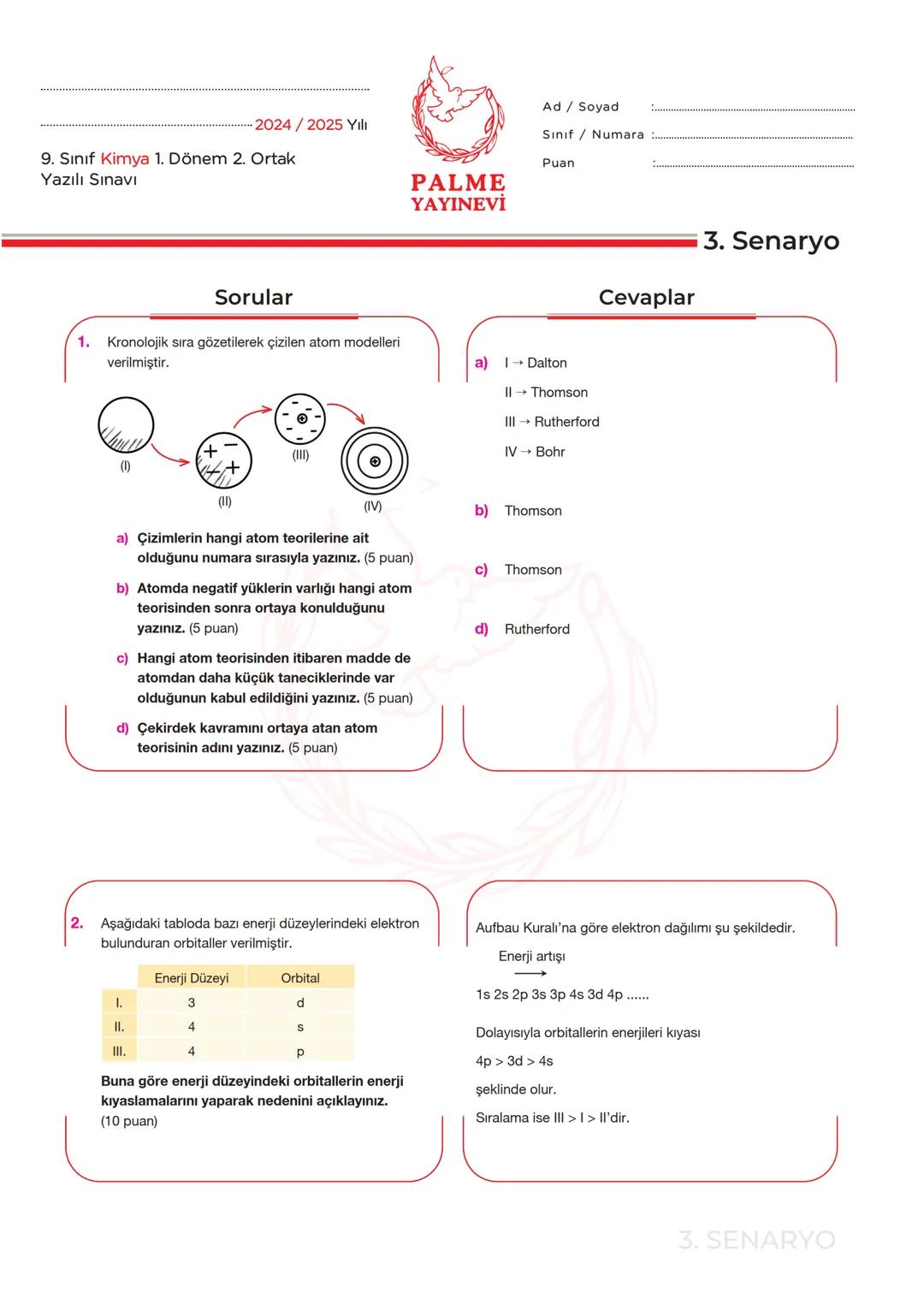
İyonlar ve Bileşik Formülleri
İyonik bileşikler, katyonlar (pozitif yüklü iyonlar) ve anyonlar (negatif yüklü iyonlar) arasındaki elektrostatik çekim kuvvetleri ile oluşur. Bir bileşiğin formülü, içerdiği iyonların toplam yüklerinin birbirini nötrleştirmesiyle belirlenir.
Ca2+ gibi bir katyon, NO3− veya SO42− gibi anyonlarla birleşerek kararlı bileşikler oluşturabilir. Bu bileşiklerin formülleri iyonların yüklerini dengeleyecek şekilde yazılır: Ca(NO3)2 ve CaSO4.
Bileşiklerin toplam atom sayısını hesaplarken, formüldeki her bir elementin atom sayısını toplamak gerekir. Örneğin, Ca(NO3)2 bileşiğinde 1 Ca, 2 N ve 6 O atomu olmak üzere toplam 9 atom vardır.
💡 Pratik Yöntem: İyonik bileşiklerin formülünü yazarken iyonların yüklerini çapraz yazarak indis olarak kullanabilirsin. Örneğin, Ca2+ ve NO3− için Ca(NO3)2 formülü elde edilir.
İyonik bileşiklerin özelliklerini, içerdikleri iyonların özellikleri belirler. Metallerin katyonları ve ametallerin anyonları, farklı kimyasal ve fiziksel özelliklere sahip çeşitli bileşikler oluşturabilir.