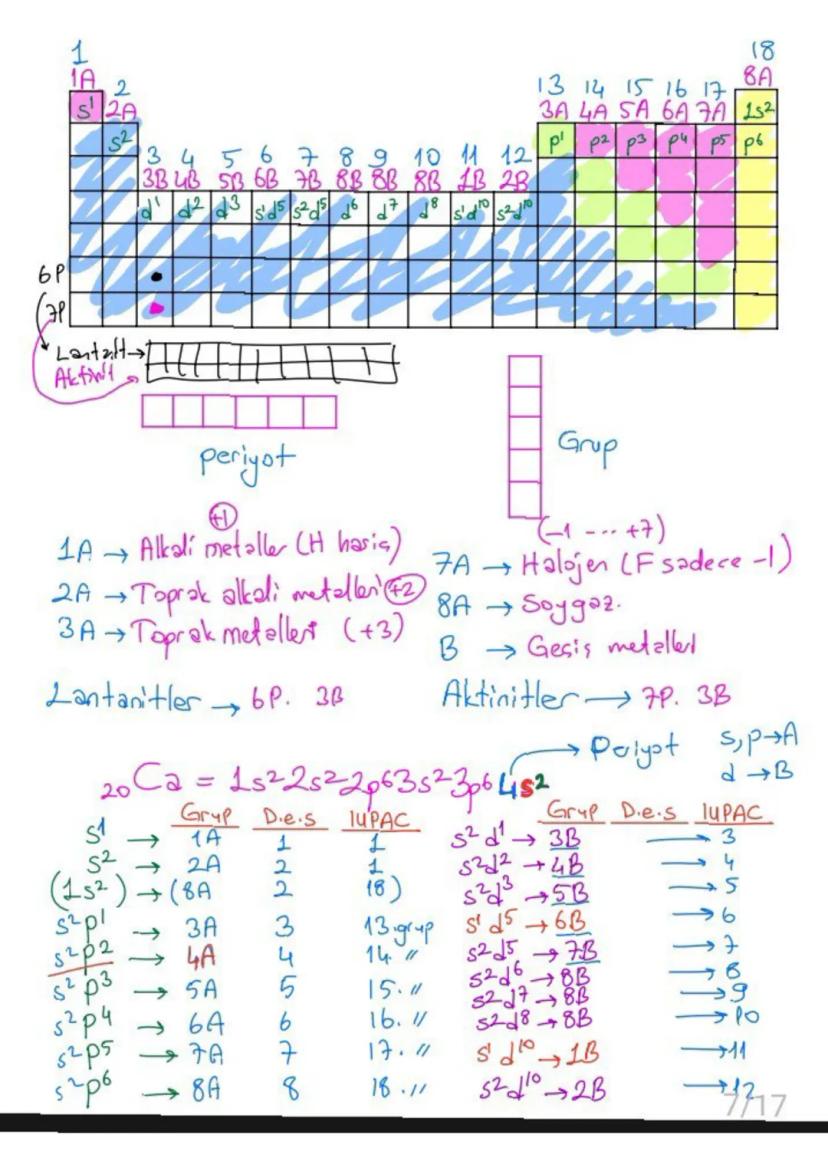
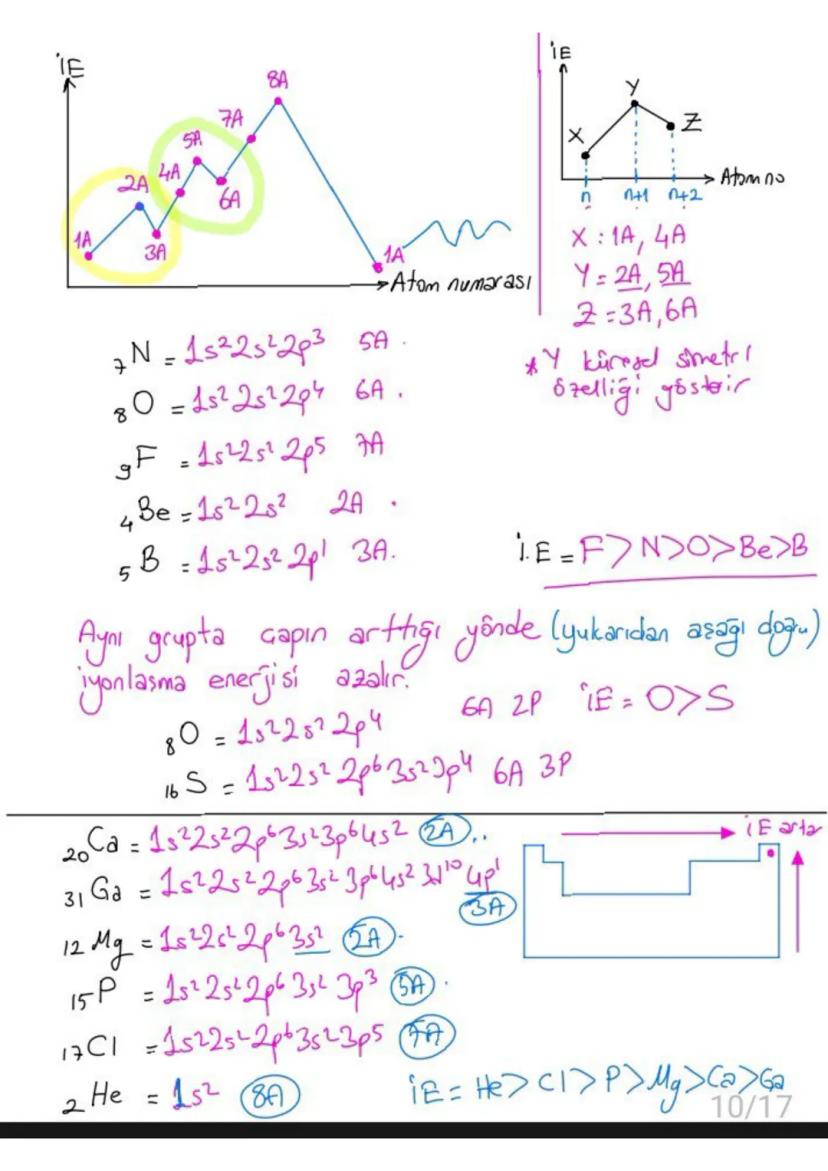
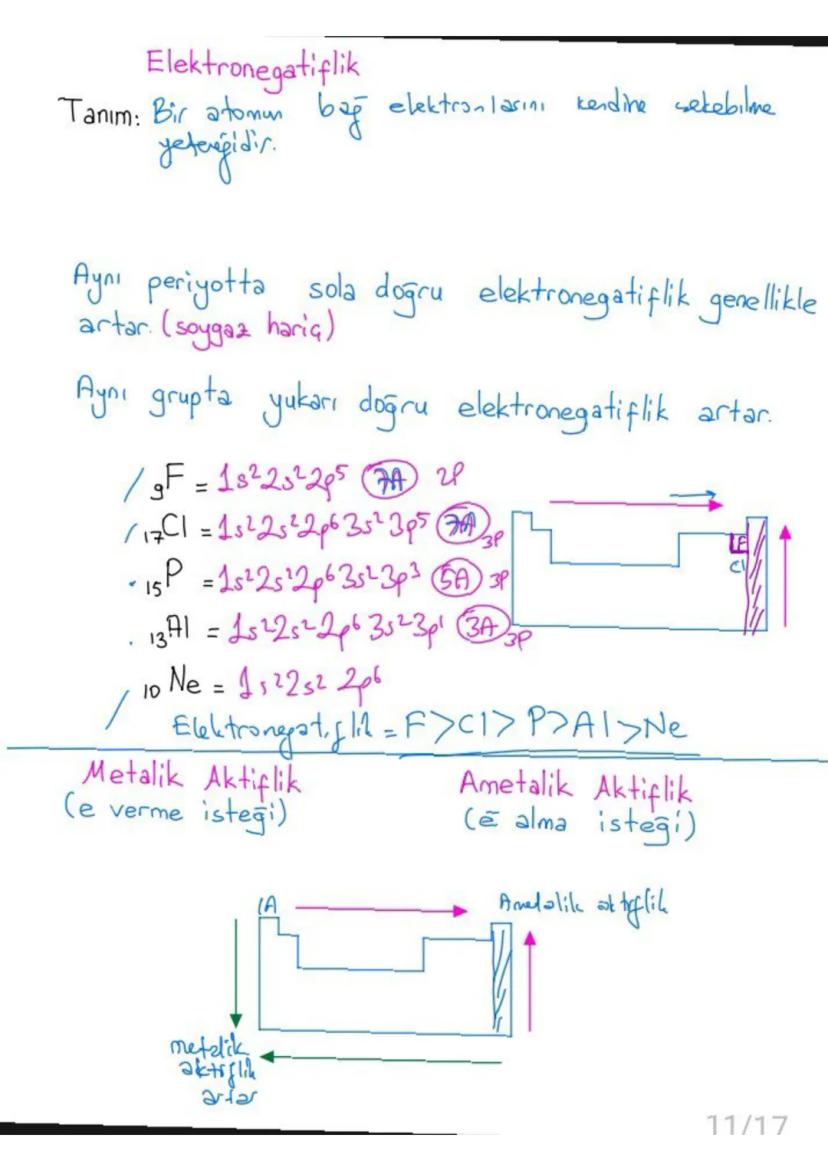
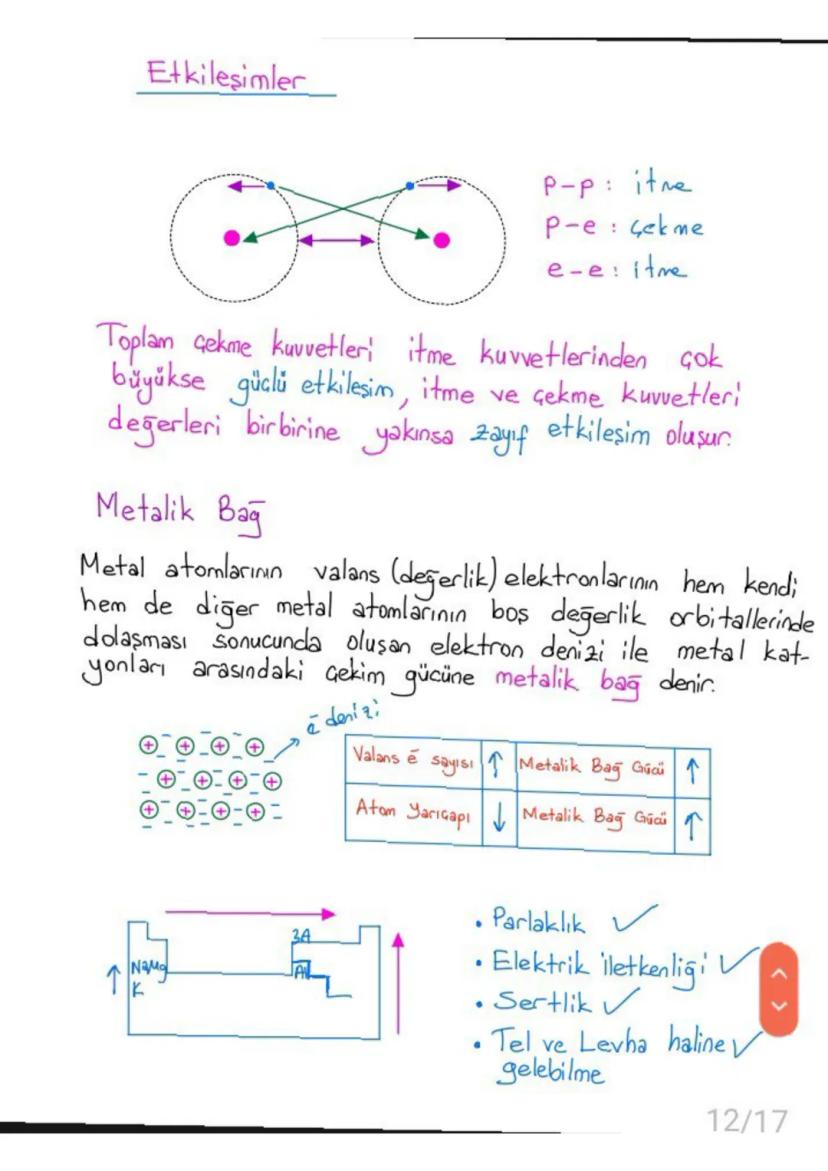
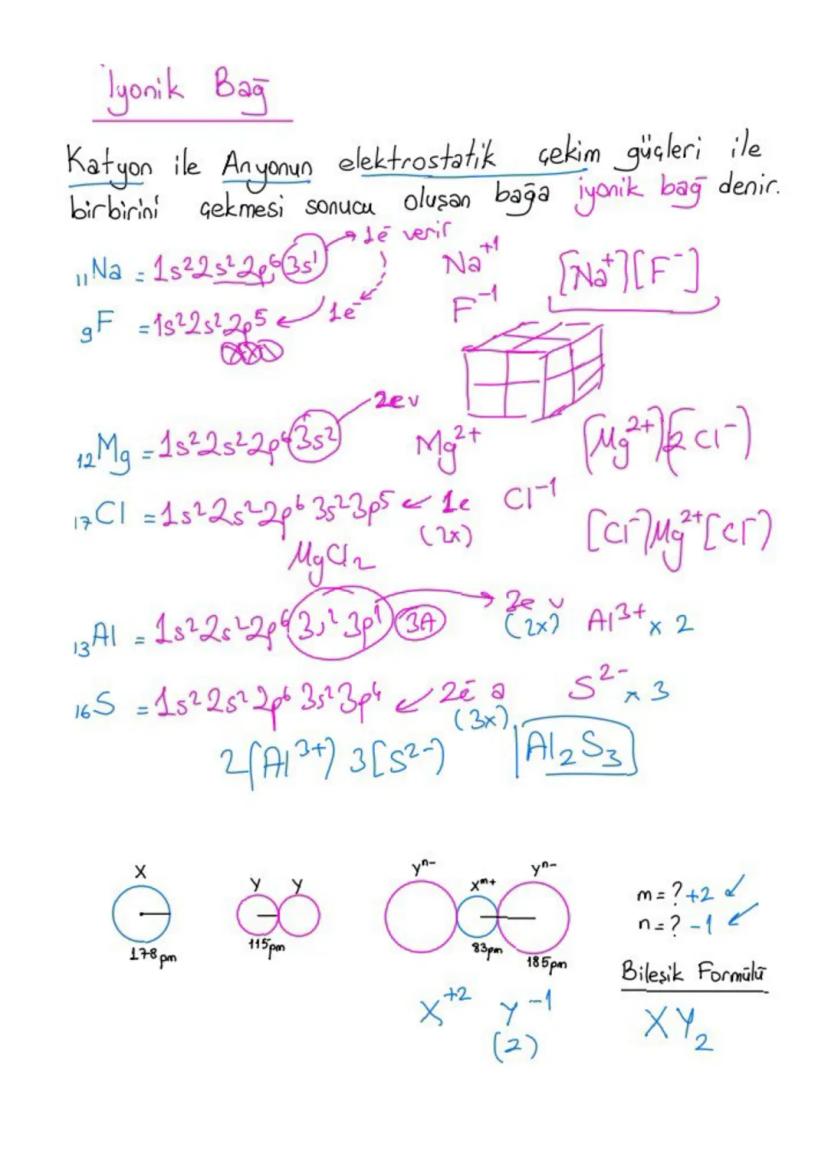
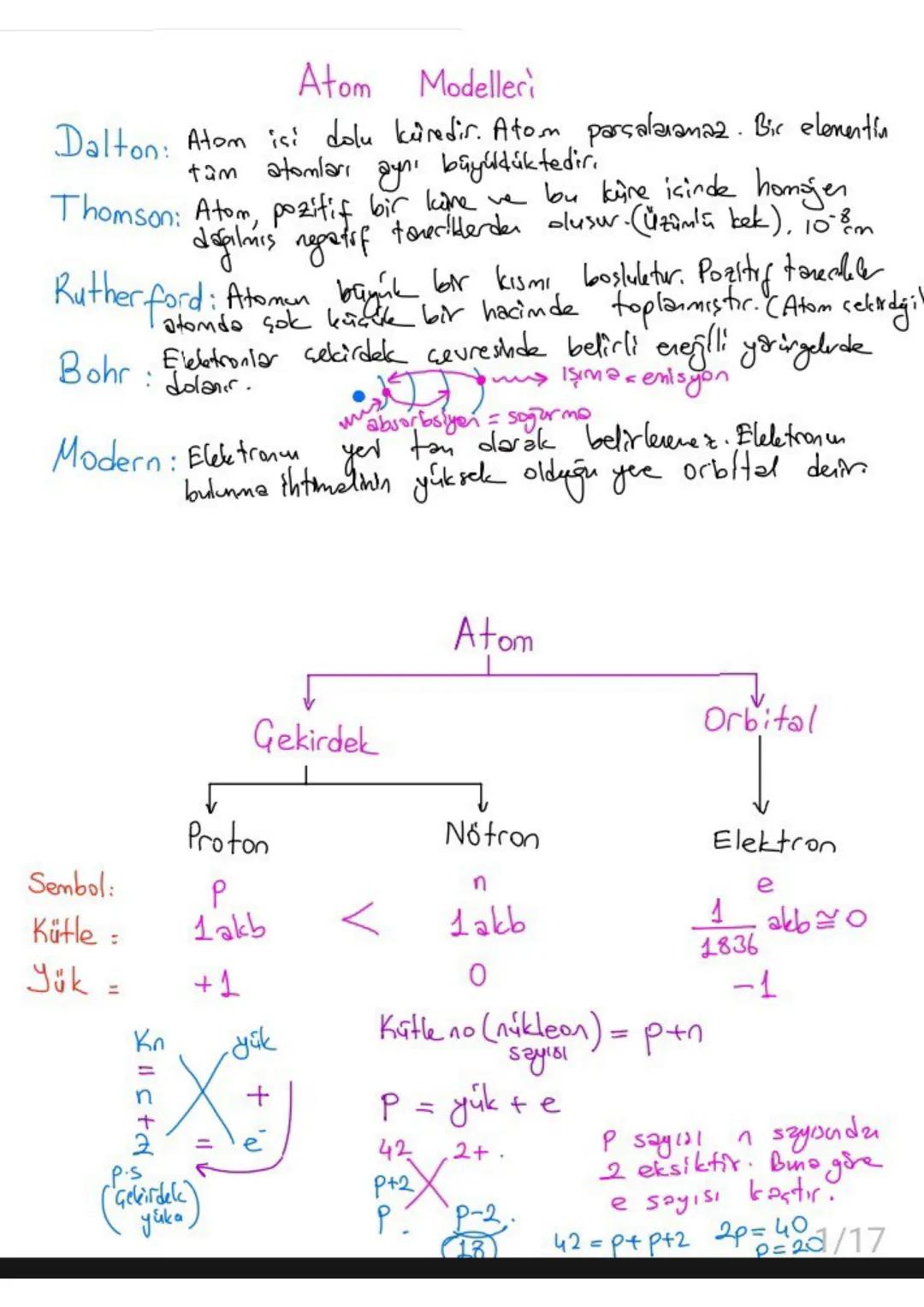
Atom Modelleri ve Atomun Yapısı
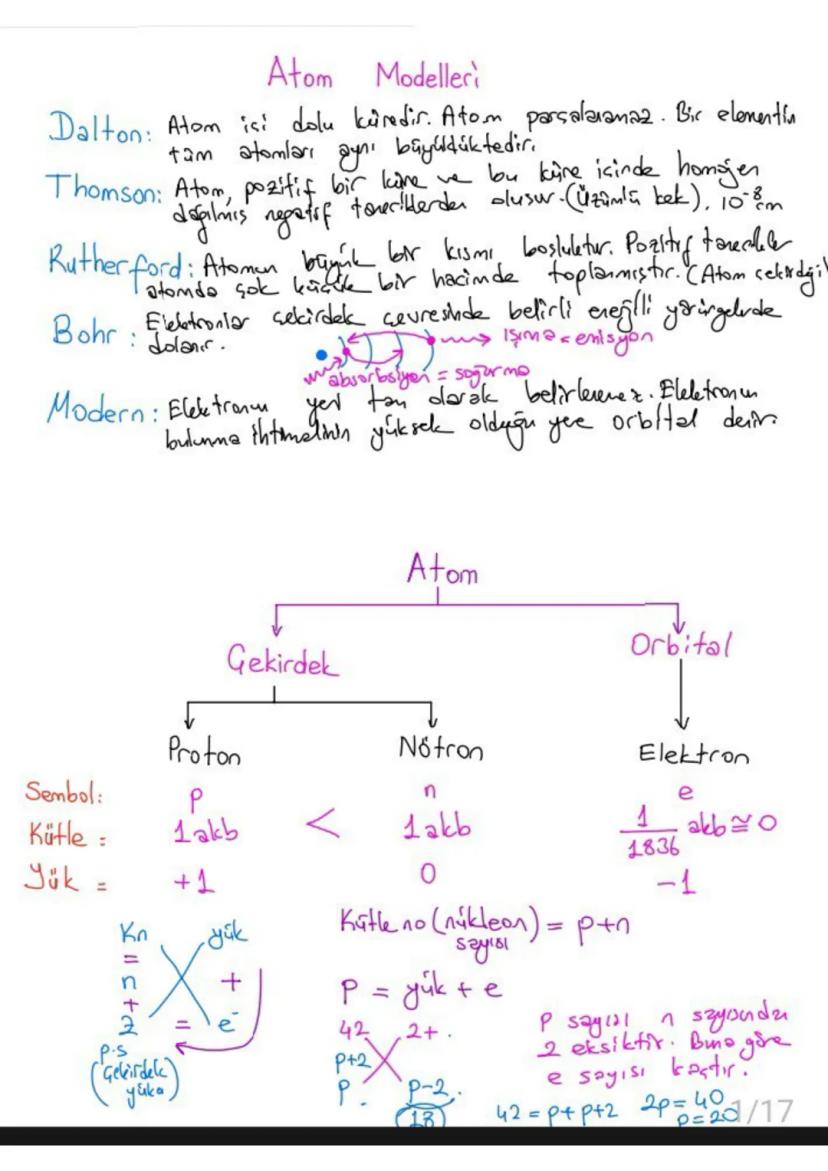
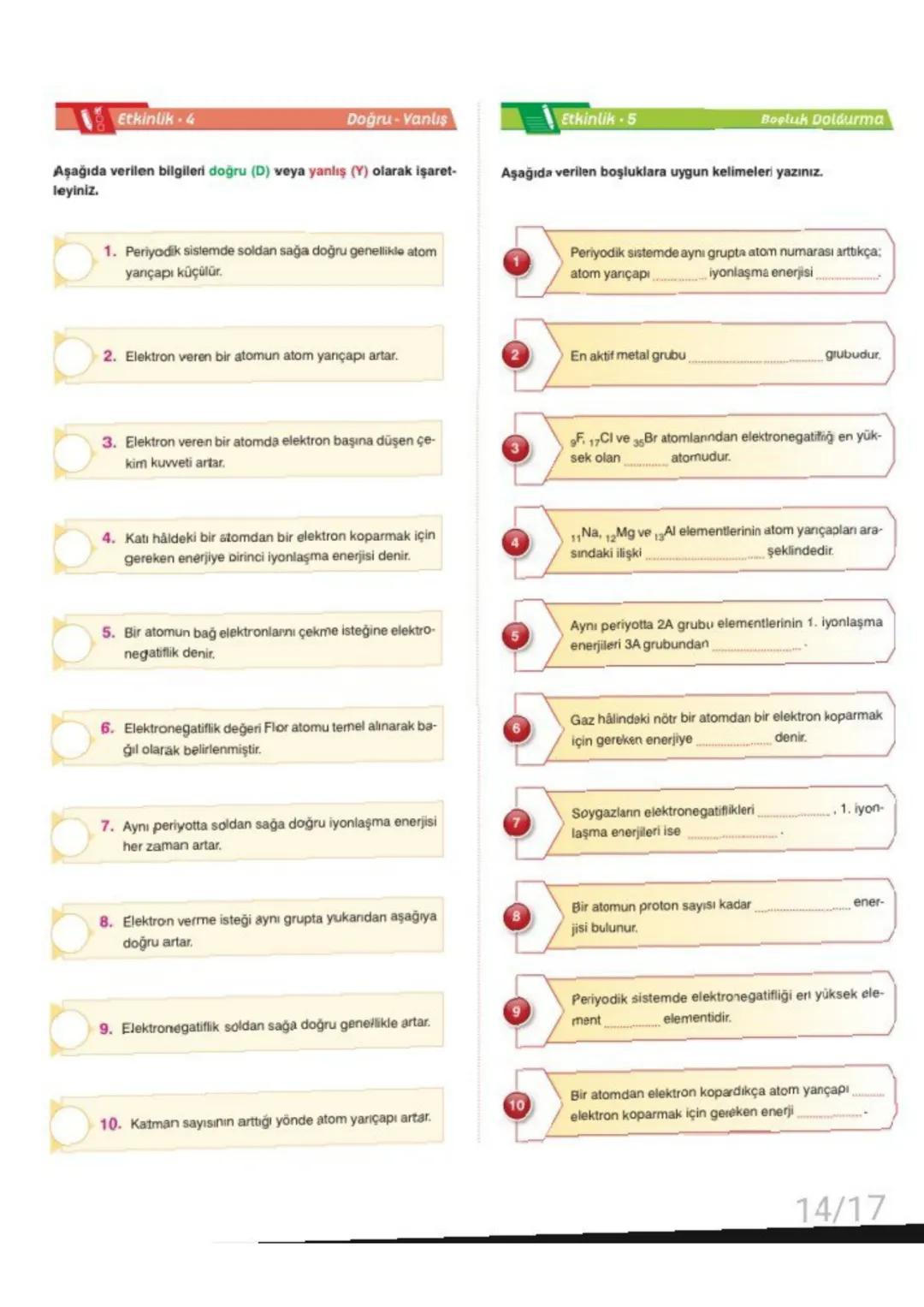
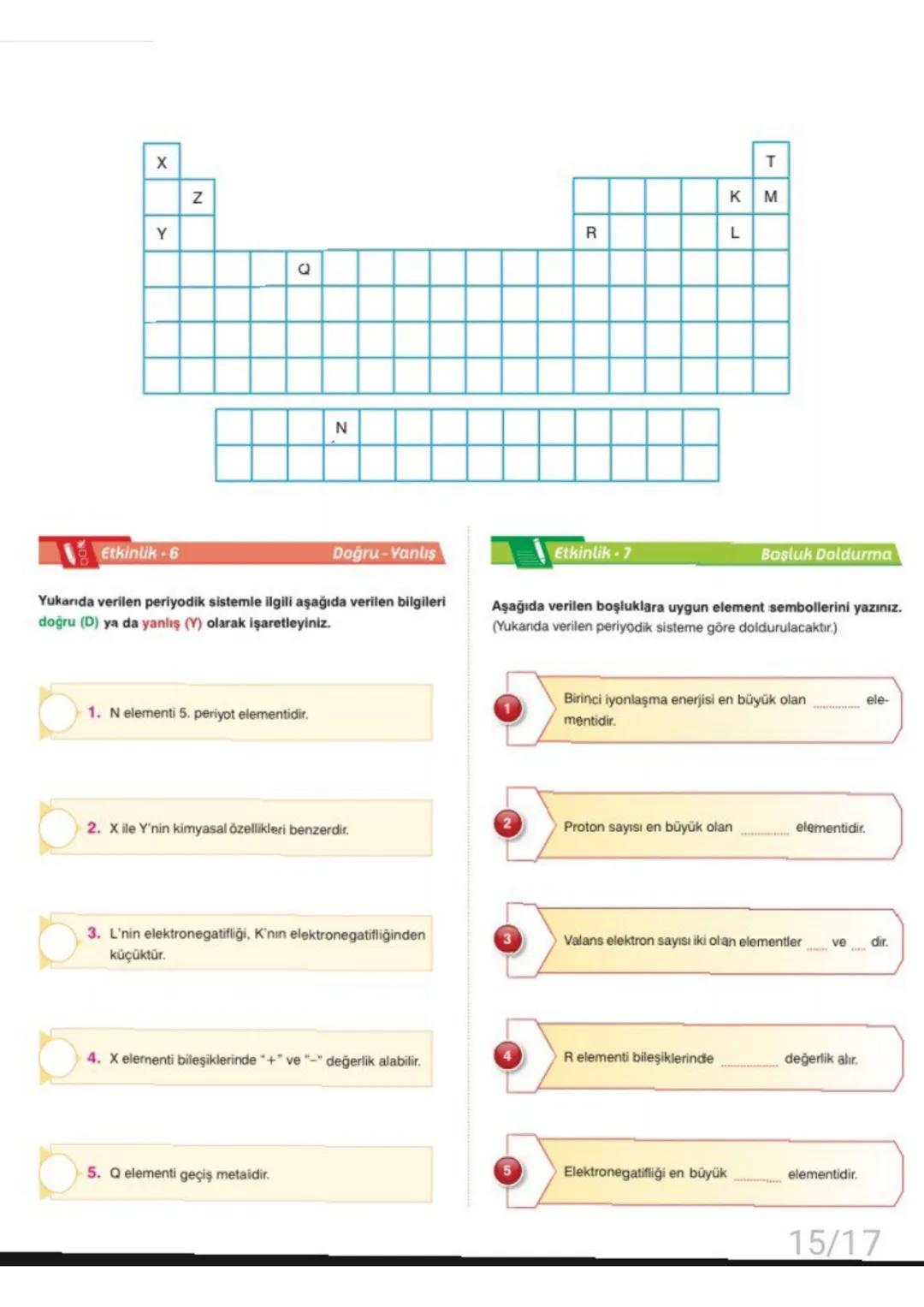
Atomun nasıl göründüğü konusunda bilim insanları farklı fikirler ortaya atmışlar. Dalton atomu bölünmez bir küre olarak düşünürken, Thomson "üzümlü kek" modeliyle elektronları keşfetti. Rutherford atomun çoğunun boş olduğunu ve merkezinde çekirdek bulunduğunu gösterdi.
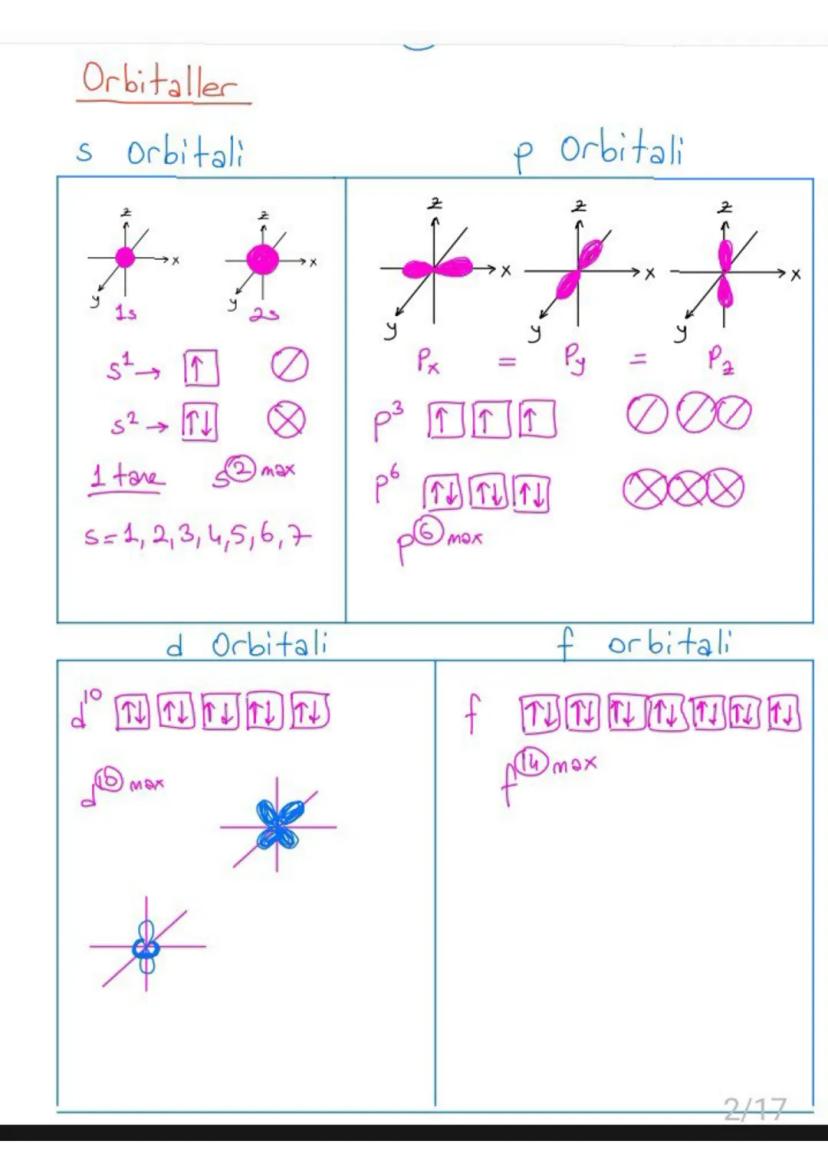
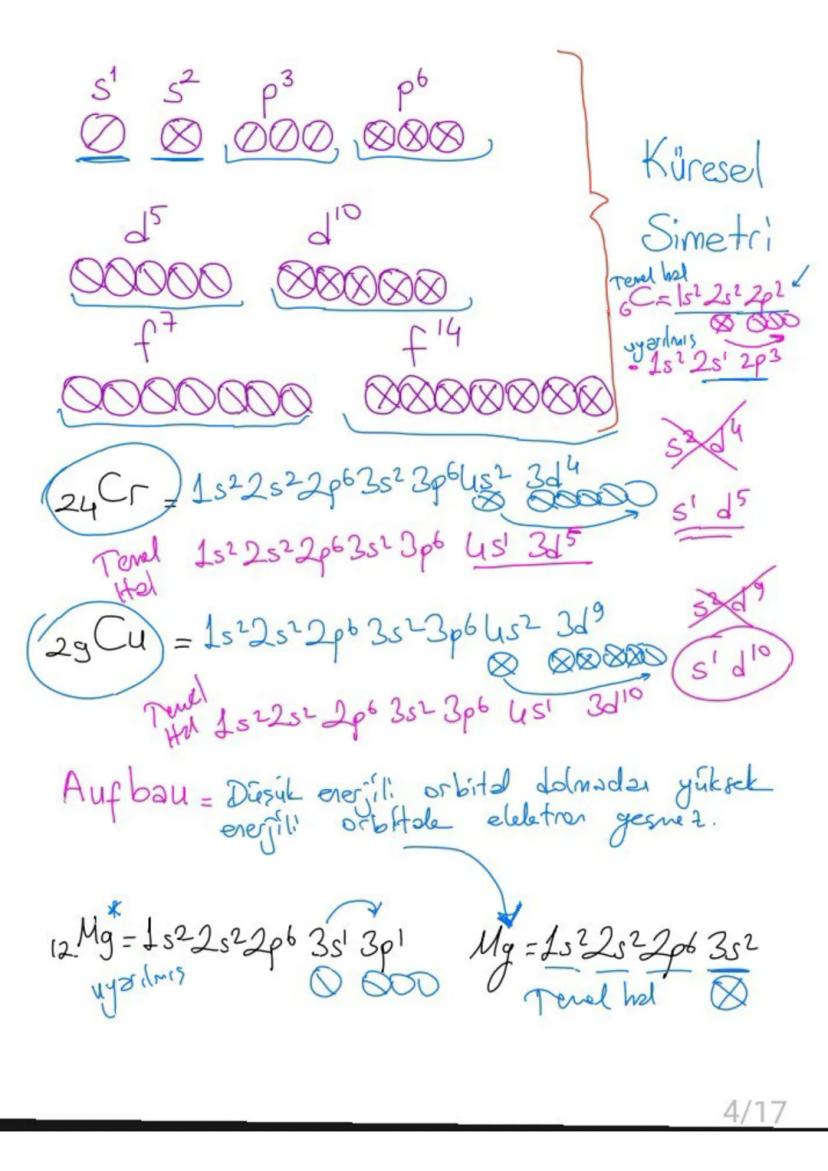
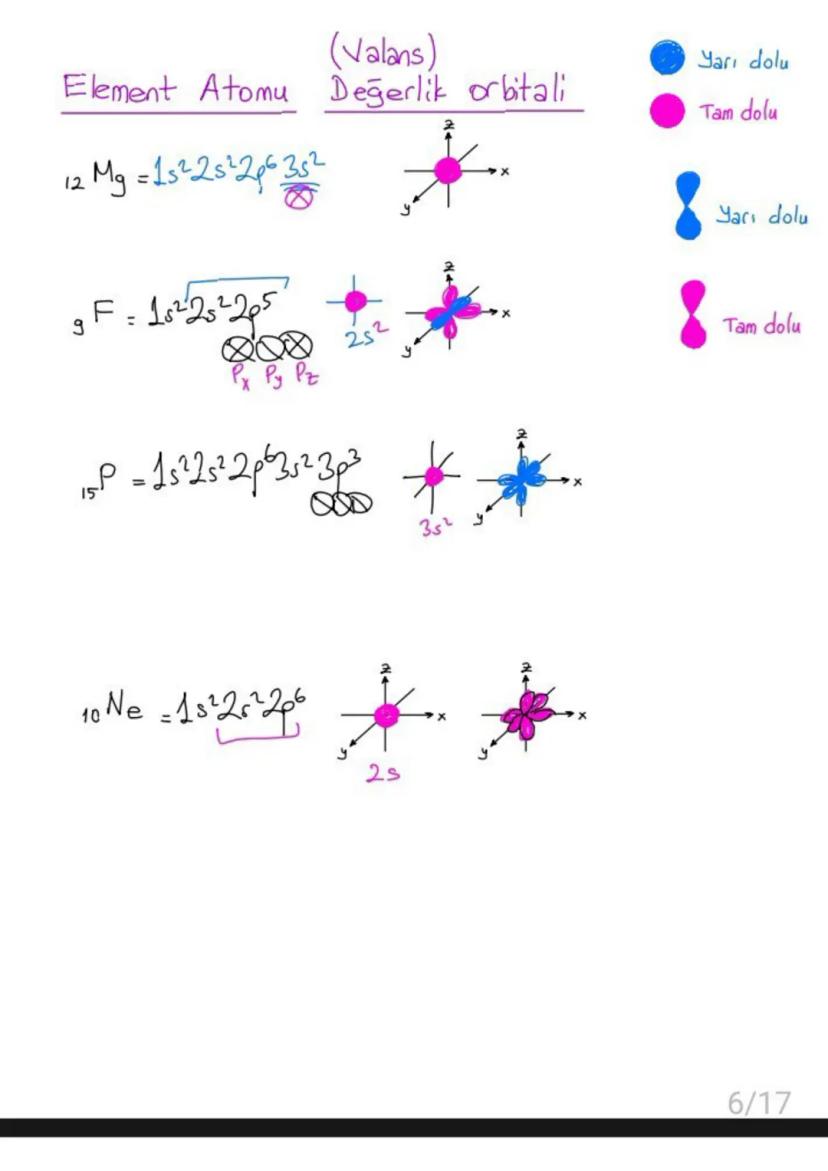
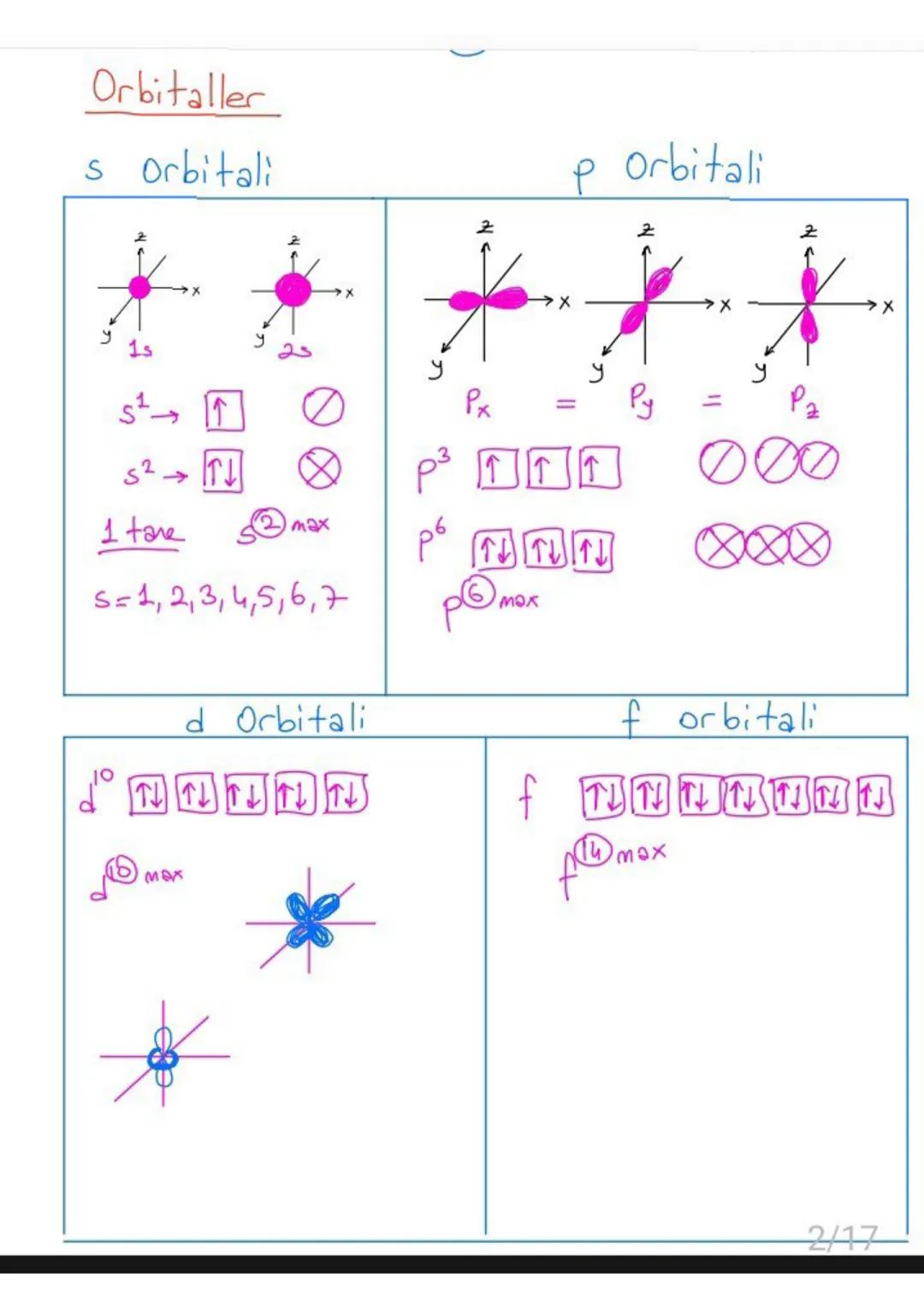
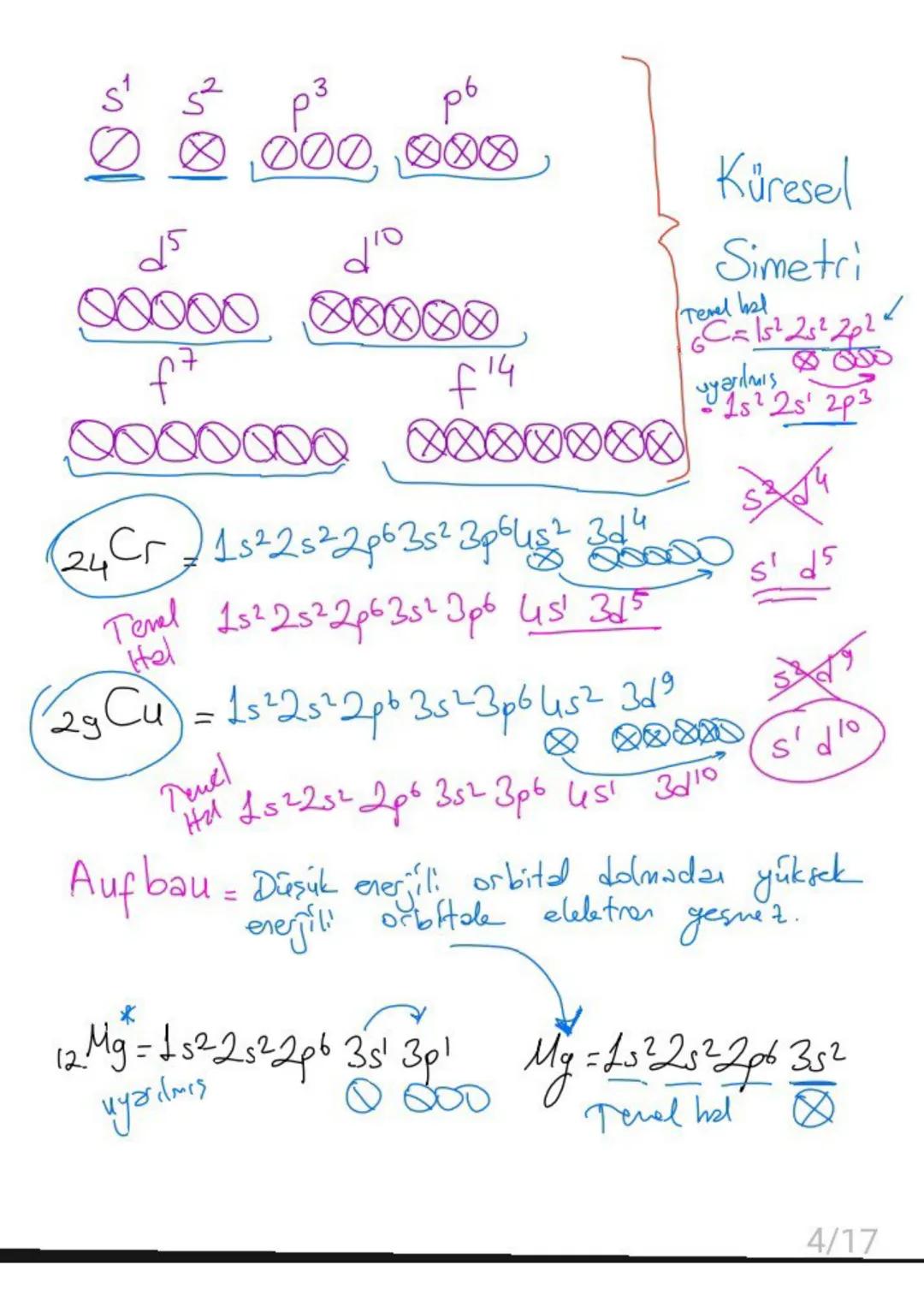
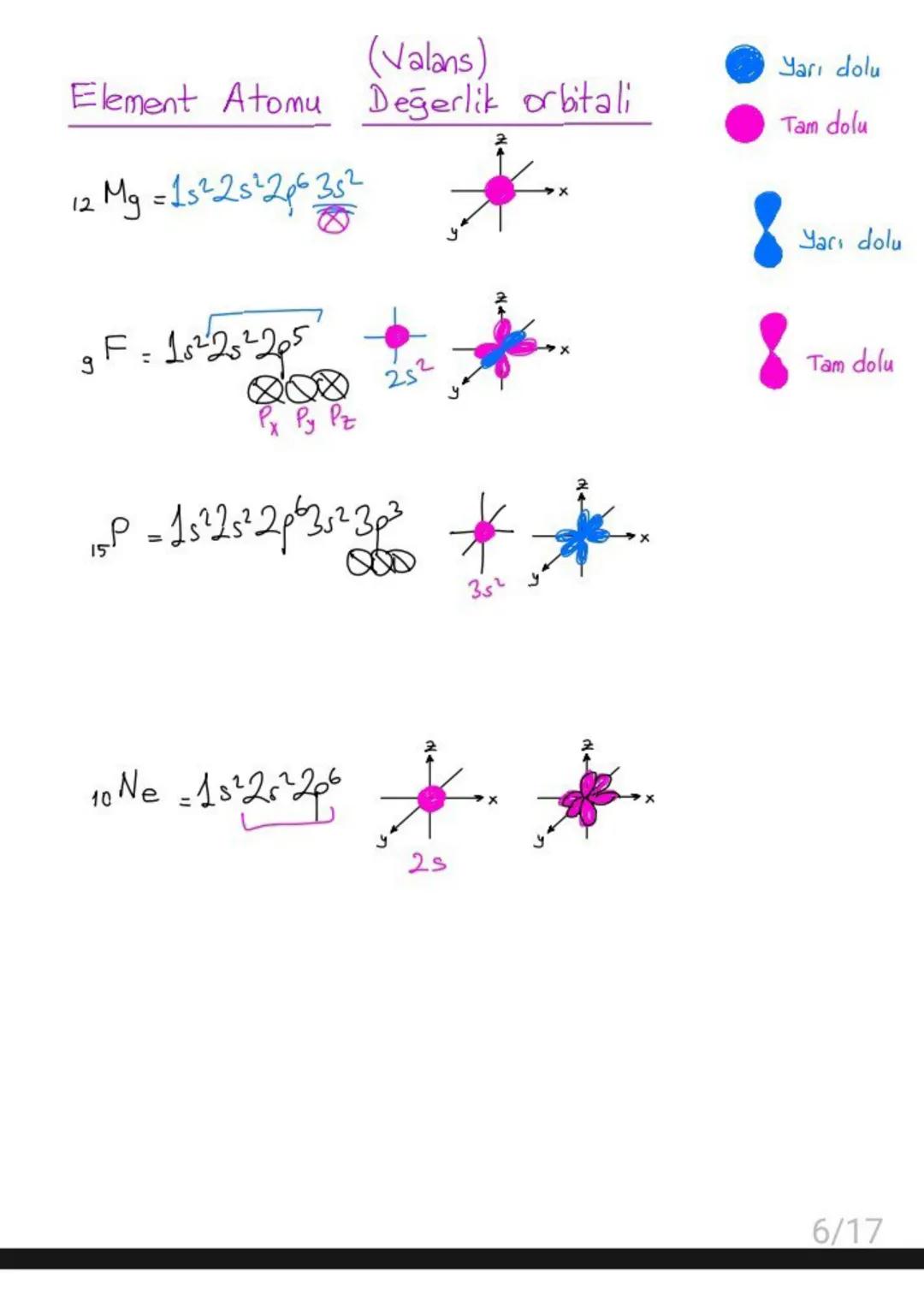
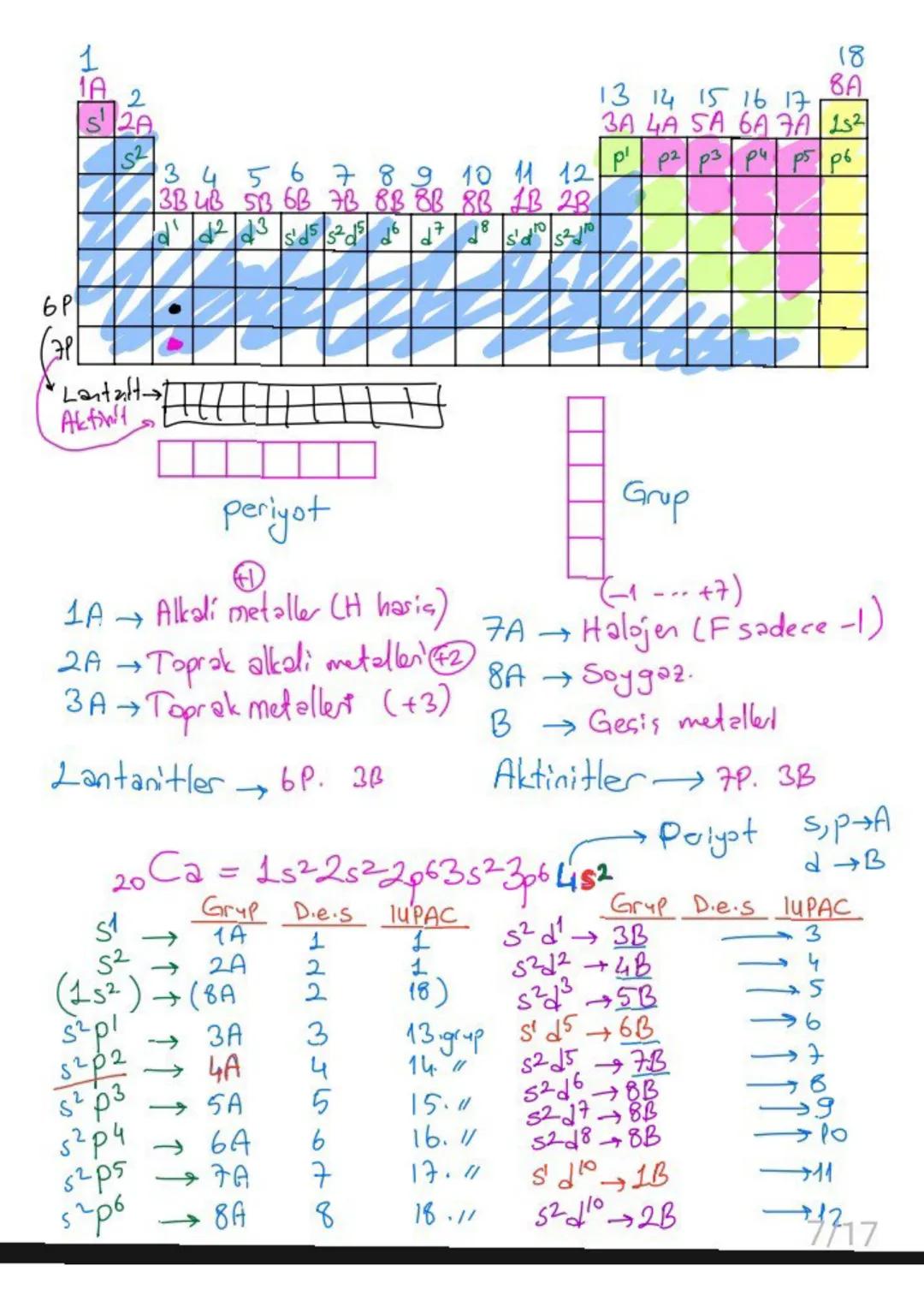
Modern atom teorisine göre elektronların yeri kesin olarak bilinemez, sadece bulunma ihtimali yüksek olan bölgeler vardır. Bu bölgelere orbital denir.
Atomun temel parçacıkları şunlardır: Proton +1yu¨k,1akbku¨tle, nötron (yüksüz, 1 akb kütle) ve elektron −1yu¨k,ihmaledilebilirku¨tle. Proton sayısı elementin kimliğini belirler.
💡 Önemli: Kütle numarası = proton sayısı + nötron sayısı formülünü mutlaka hatırla!