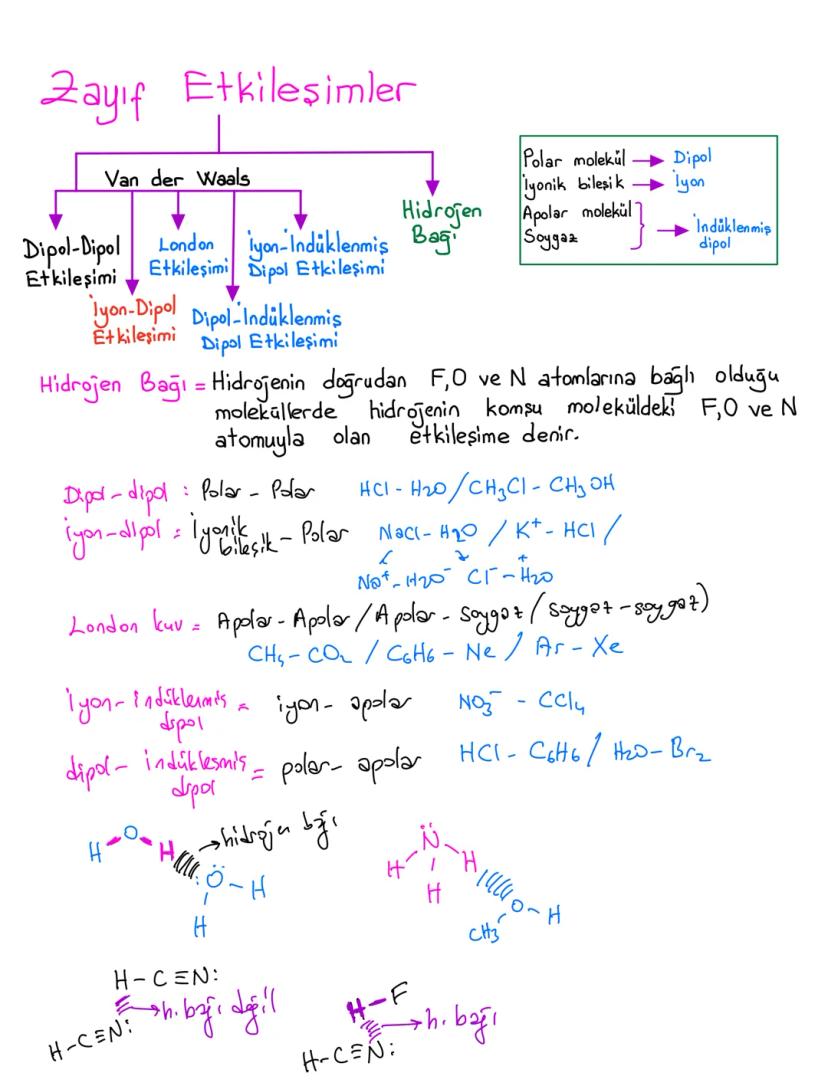
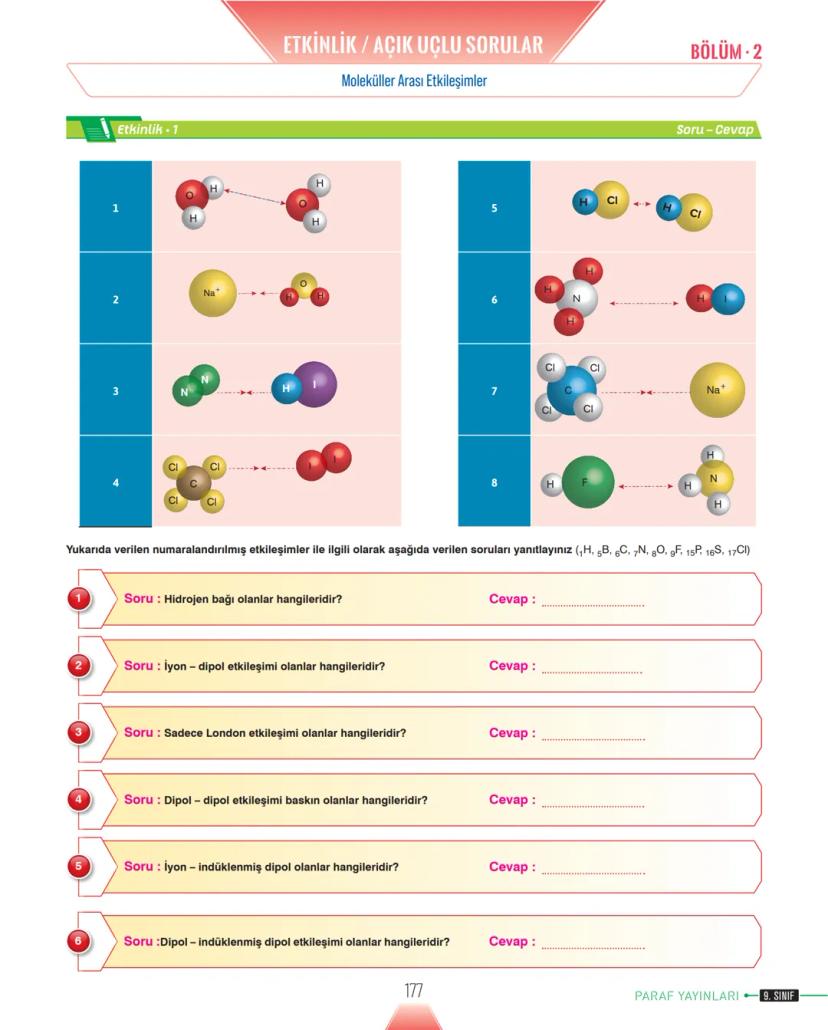
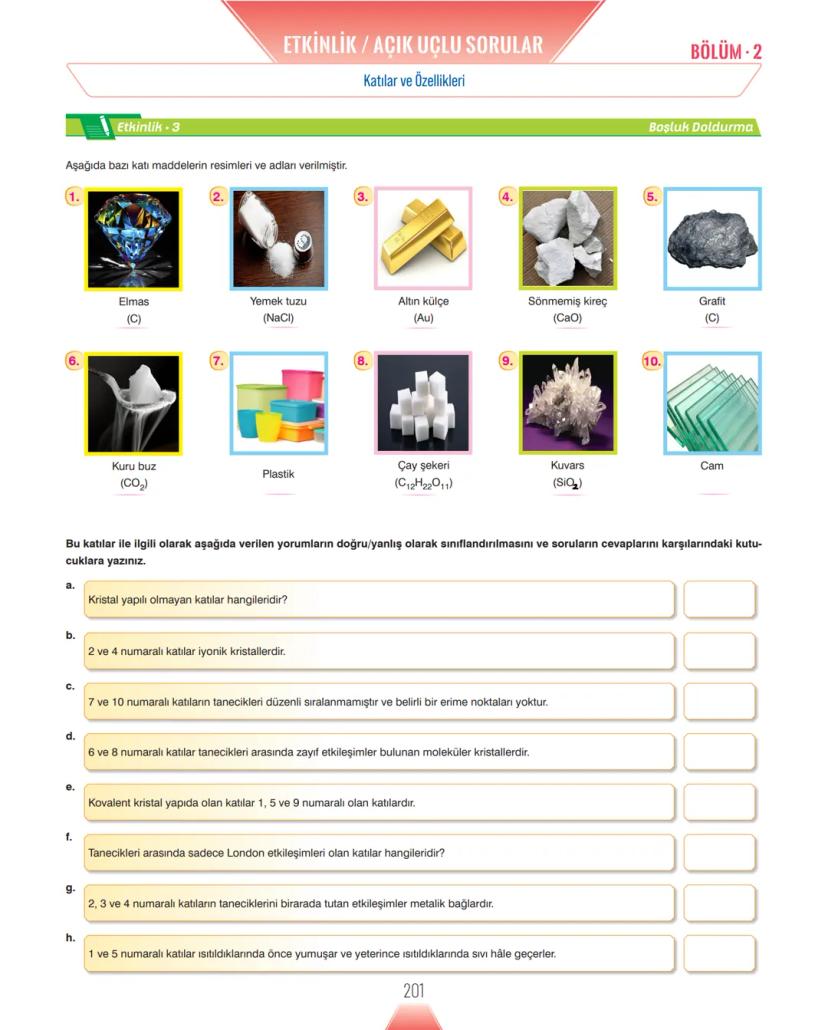
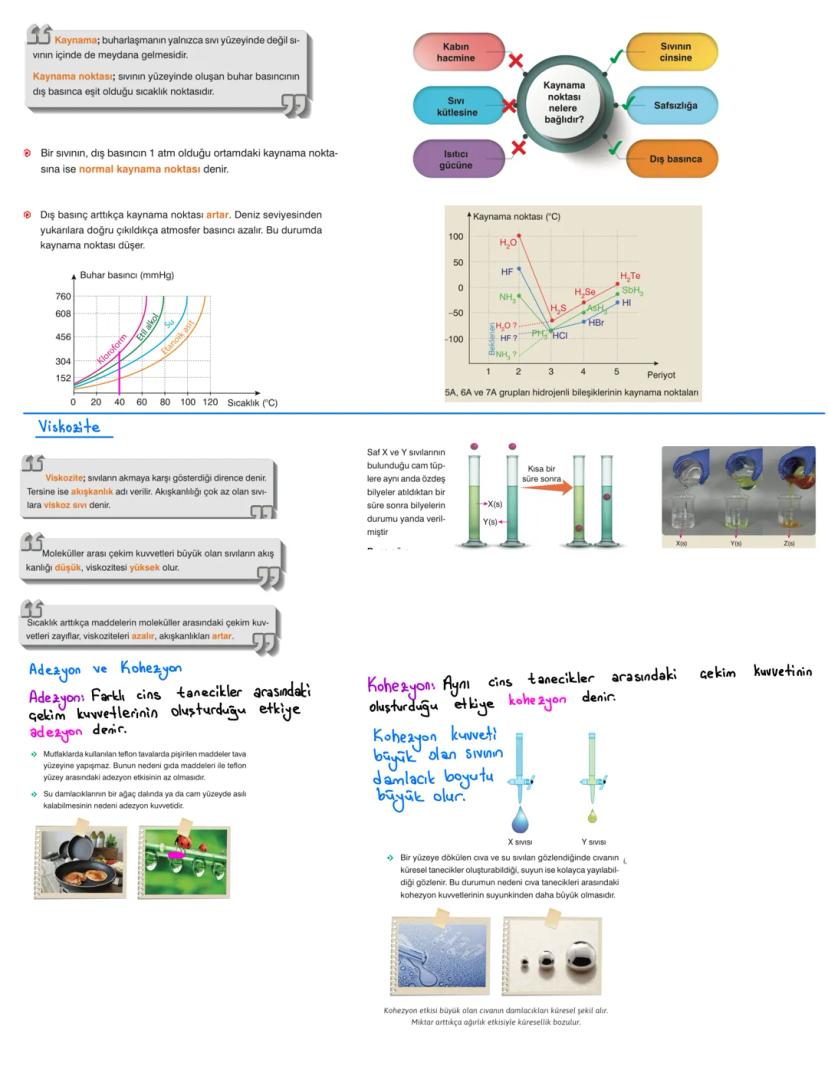
Yüzey Gerilimini Etkileyen Faktörler ve Nanoteknoloji
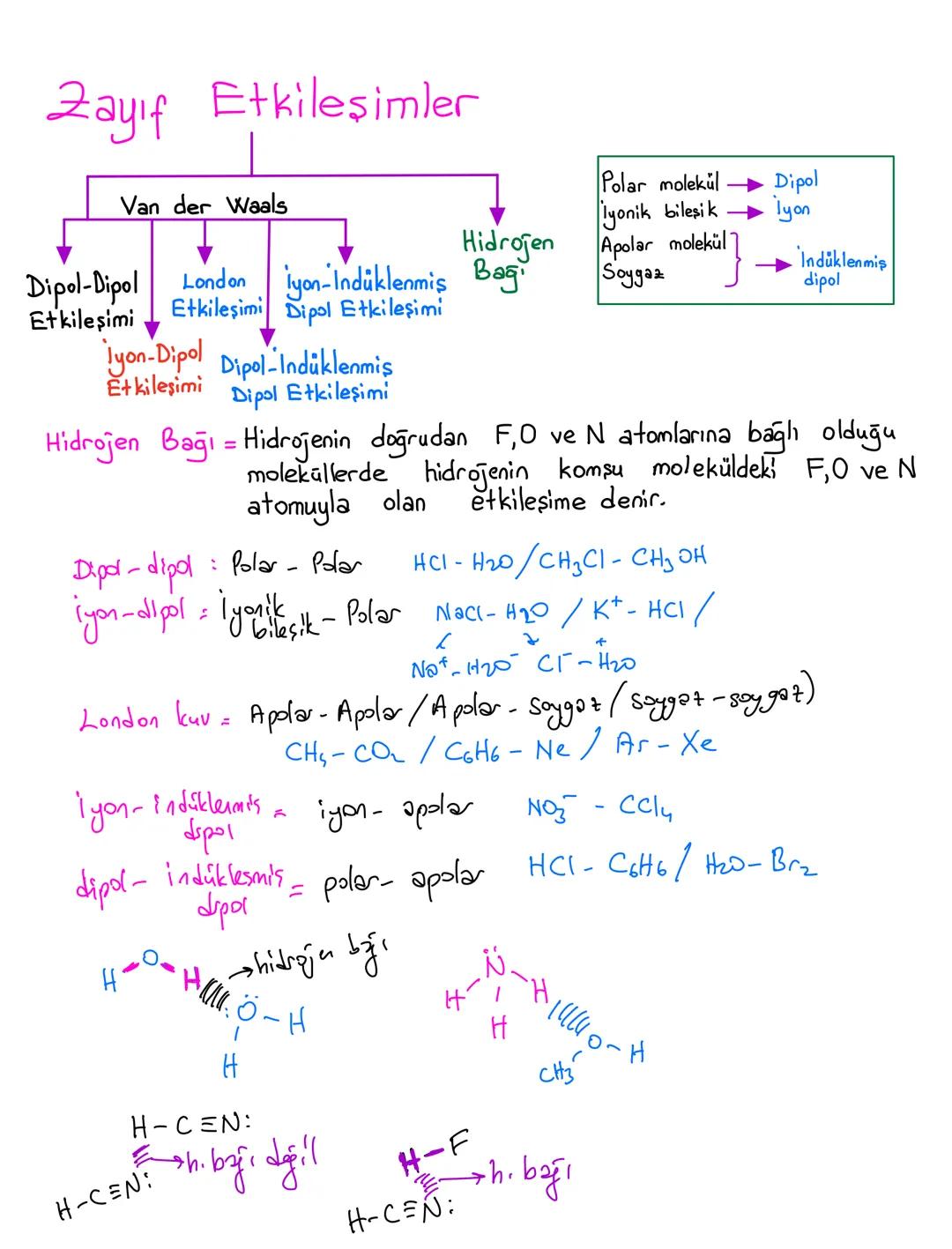
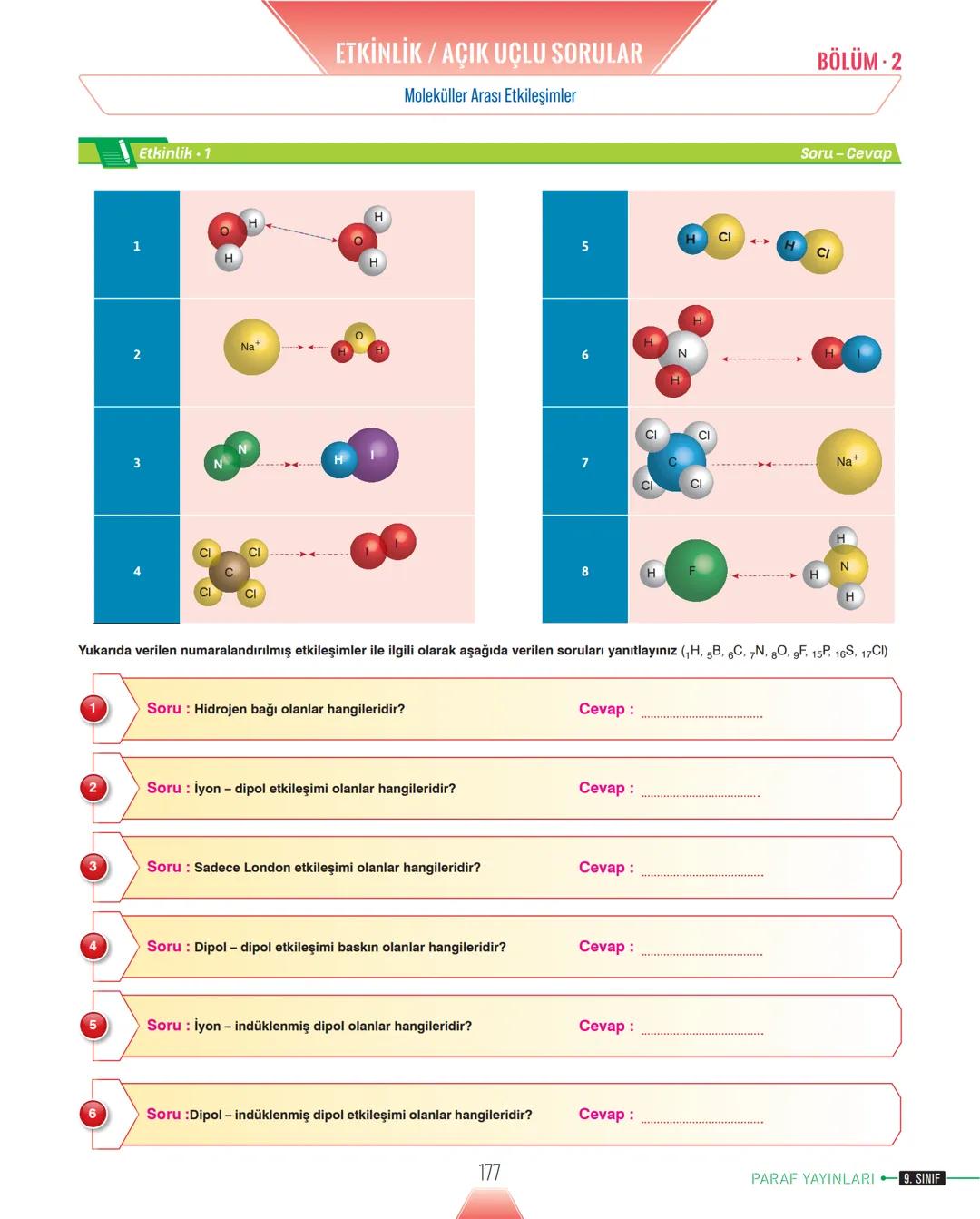
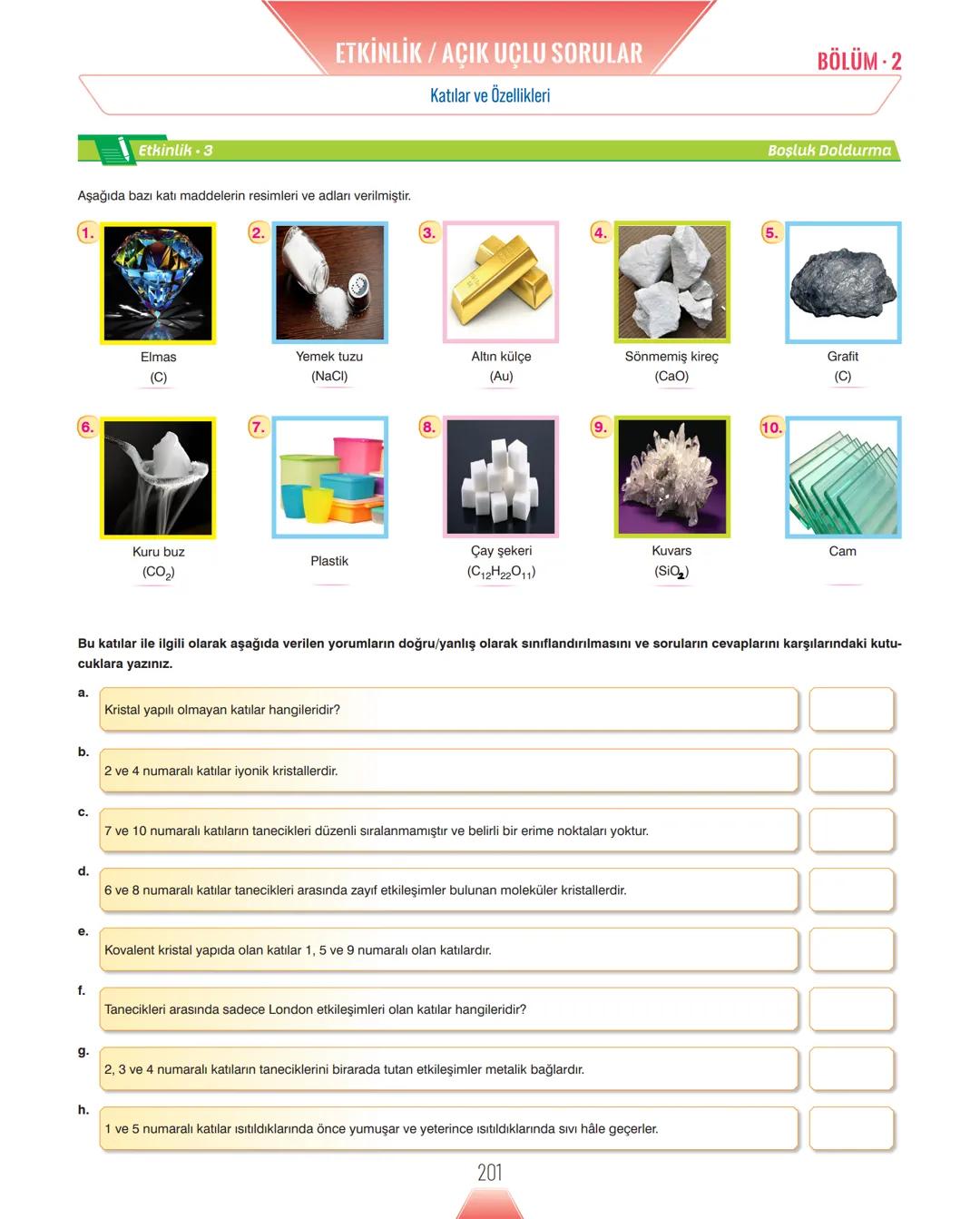
Yüzey gerilimi sıvının cinsine bağlıdır - tanecikler arası çekim kuvveti büyük olan sıvıların yüzey gerilimi de yüksektir. Genel kural: kaynama noktası yüksek = yüzey gerilimi yüksek.
Sabun ve deterjan gibi yüzey aktif maddeler yüzey gerilimini azaltarak temizliği kolaylaştırır. Tuzlar ise yüzey inaktif maddeler olarak yüzey gerilimini artırır.
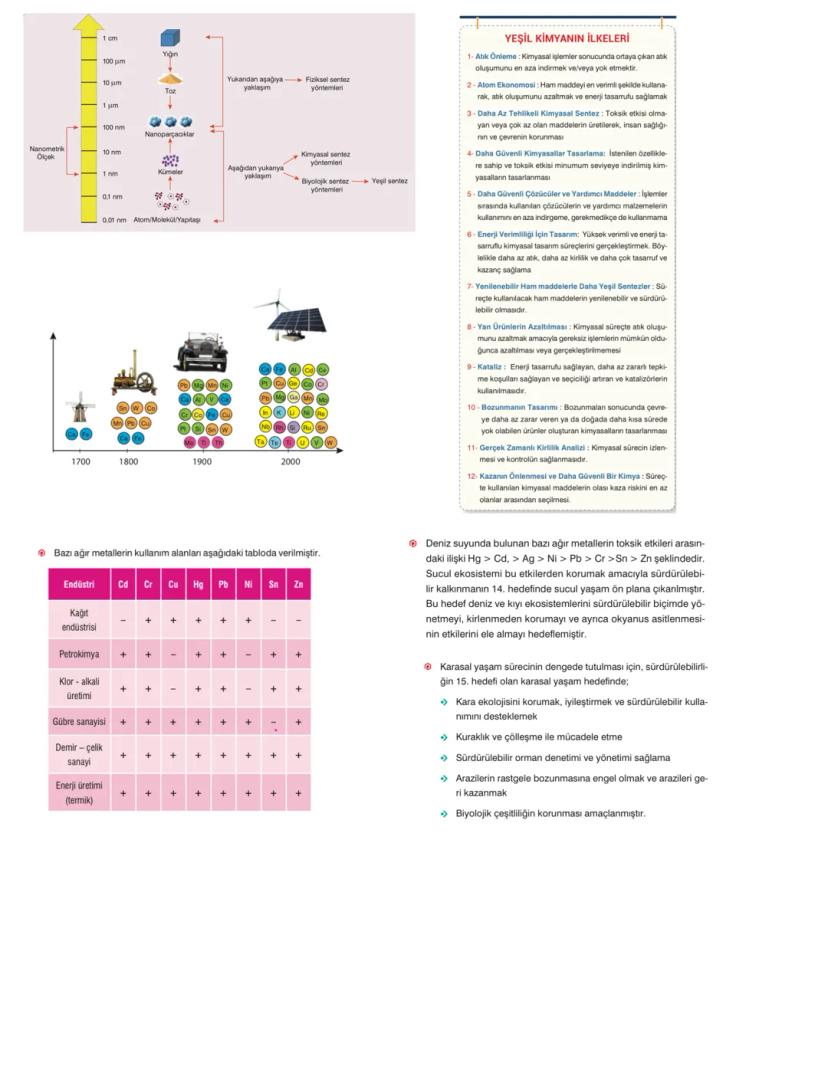
Nanoteknoloji 1-100 nanometre boyutundaki parçacıklarla çalışır. Bu boyutta maddelerin fiziksel ve kimyasal özellikleri değişir! Elektronik, tıp, tekstil, kozmetik gibi birçok alanda kullanılır.
Nanoparçacıklar tıpta görüntüleme, kanser tedavisi, akıllı ilaç tasarımı gibi devrimsel uygulamalara sahip. Tekstilde ise kir tutmayan, bakteri tutmayan, renk değiştiren kumaşlar üretilebiliyor.
Gelecek Teknolojisi: Nanorobotlar damar içinde oksijen taşıyabilir, diş temizliği yapabilir - bilim kurgu gerçek oluyor!