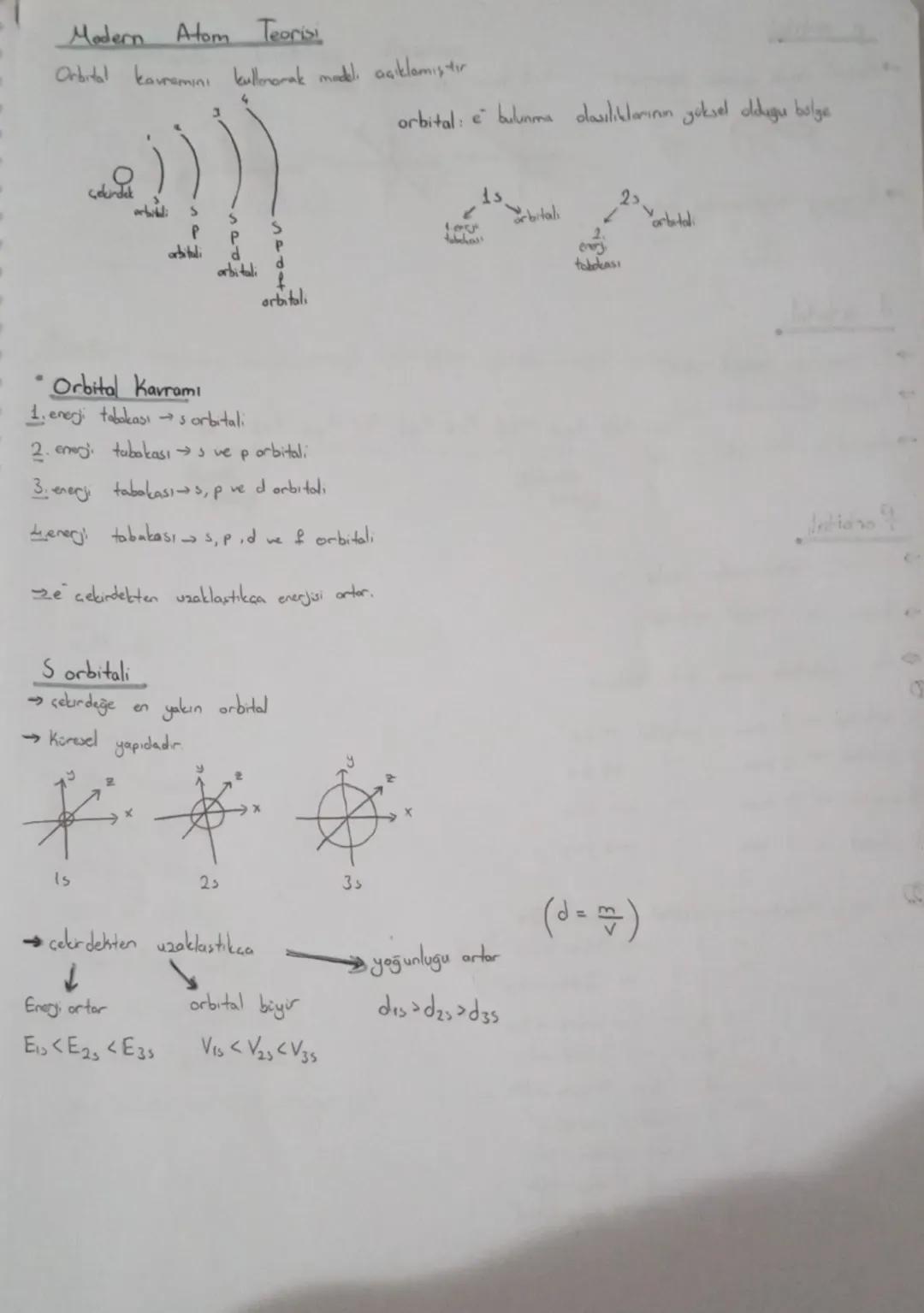
Modern Atom Teorisi ve Orbitaller
Atom yapısını anlamak için bilmemiz gereken en temel kavram orbital'dir. Orbital, elektronların bulunma olasılığının yüksek olduğu bölgeyi ifade eder. Her enerji tabakası farklı sayıda ve türde orbital içerir.
Enerji tabakaları ve içerdikleri orbitaller şöyle sıralanır: 1. tabaka sadece s orbitali, 2. tabaka s ve p orbitalleri, 3. tabaka s, p ve d orbitalleri, 4. tabaka ise s, p, d ve f orbitallerini içerir. Elektronlar çekirdekten uzaklaştıkça enerjileri artar.
S orbitali en temel orbital türüdür ve küresel bir yapıya sahiptir. 1s, 2s, 3s gibi farklı enerji seviyelerinde bulunabilir. S orbitalleri hakkında bilmen gereken önemli bilgiler:
- Çekirdeğe en yakın orbitaldir
- Enerji seviyesi arttıkça (1s → 2s → 3s) orbital büyür
- Çekirdekten uzaklaştıkça elektronun enerjisi artar
- Elektronun yoğunluğu da orbitalin büyüklüğüyle artar
💡 Hızlı Not: S orbitallerinin yoğunluğu, çekirdeğe olan mesafeleri ile ters orantılıdır. Yani d1s > d2s > d3s olur. Enerji ise mesafe ile doğru orantılıdır: E1s < E2s < E3s.