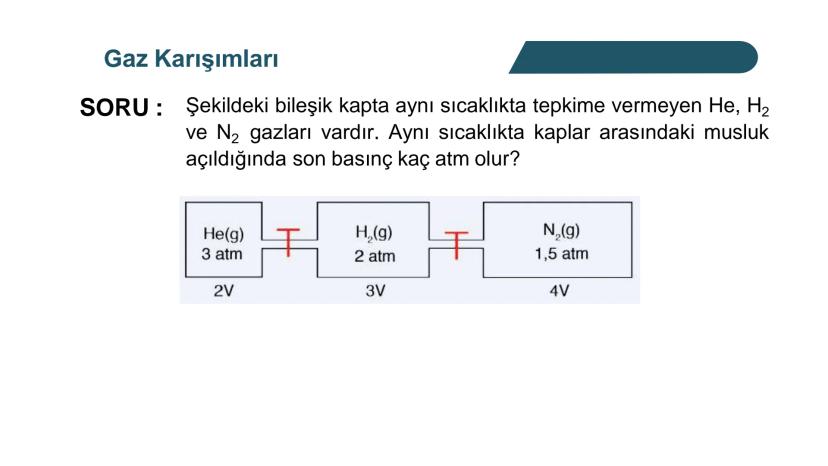
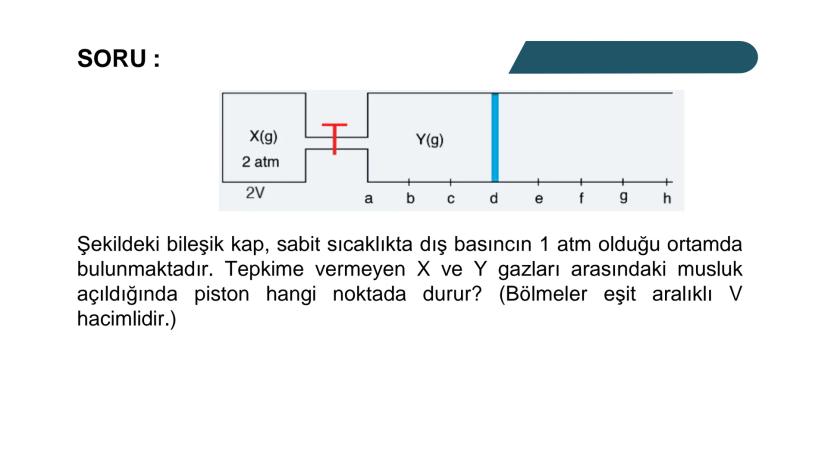
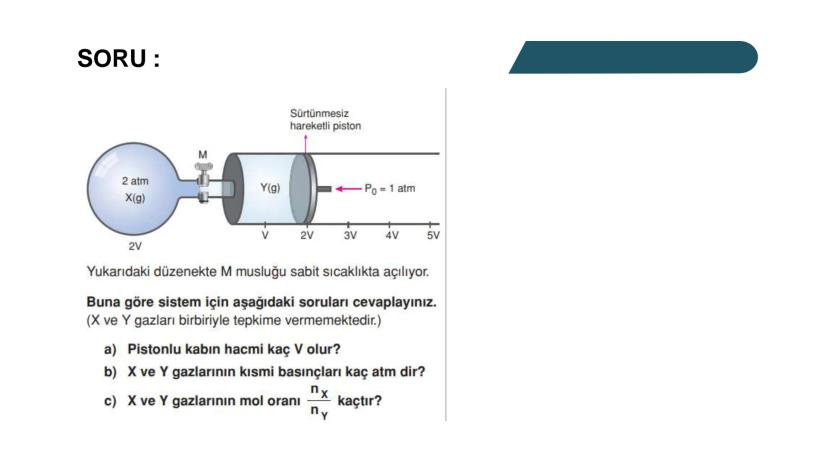
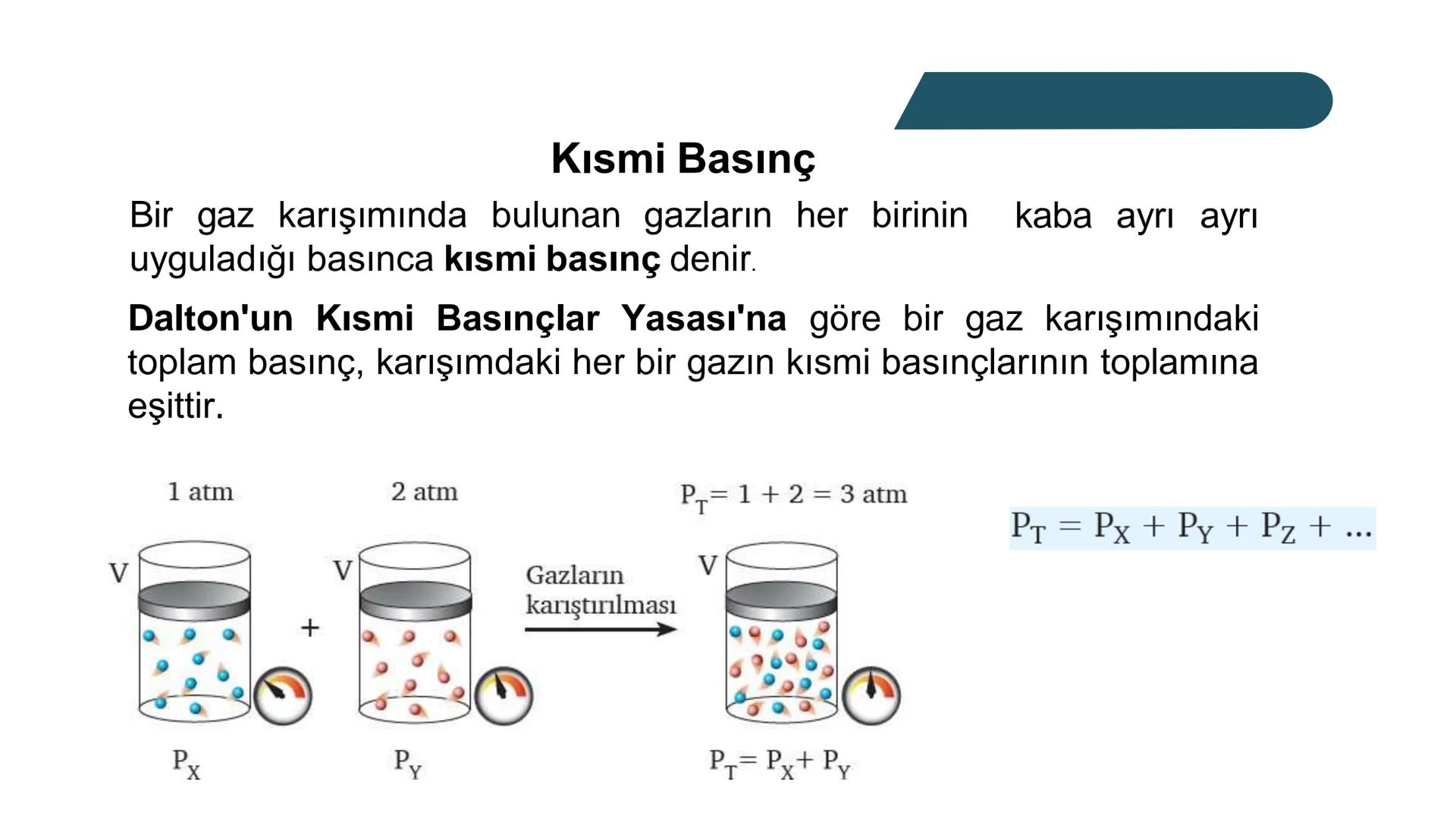
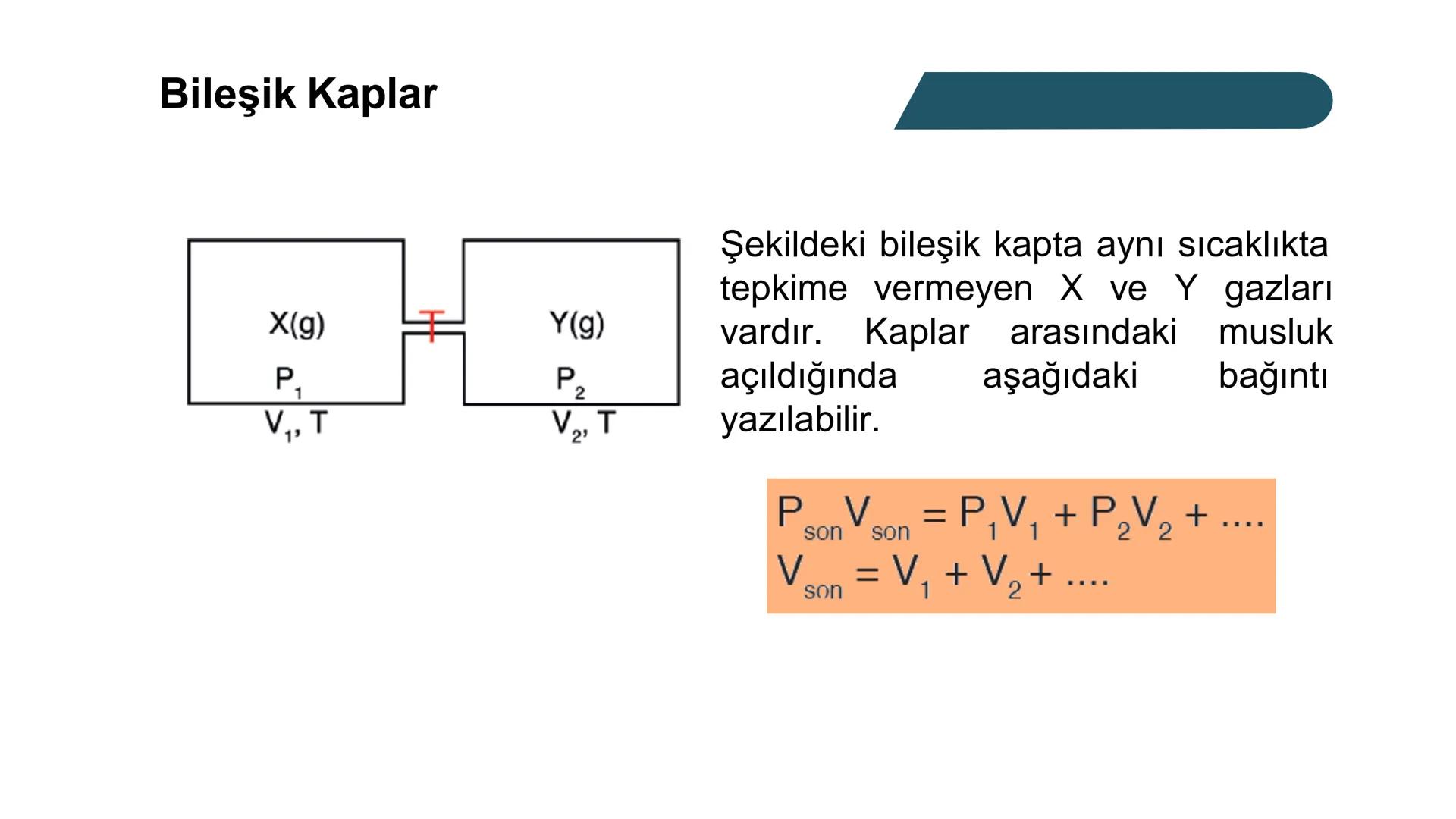
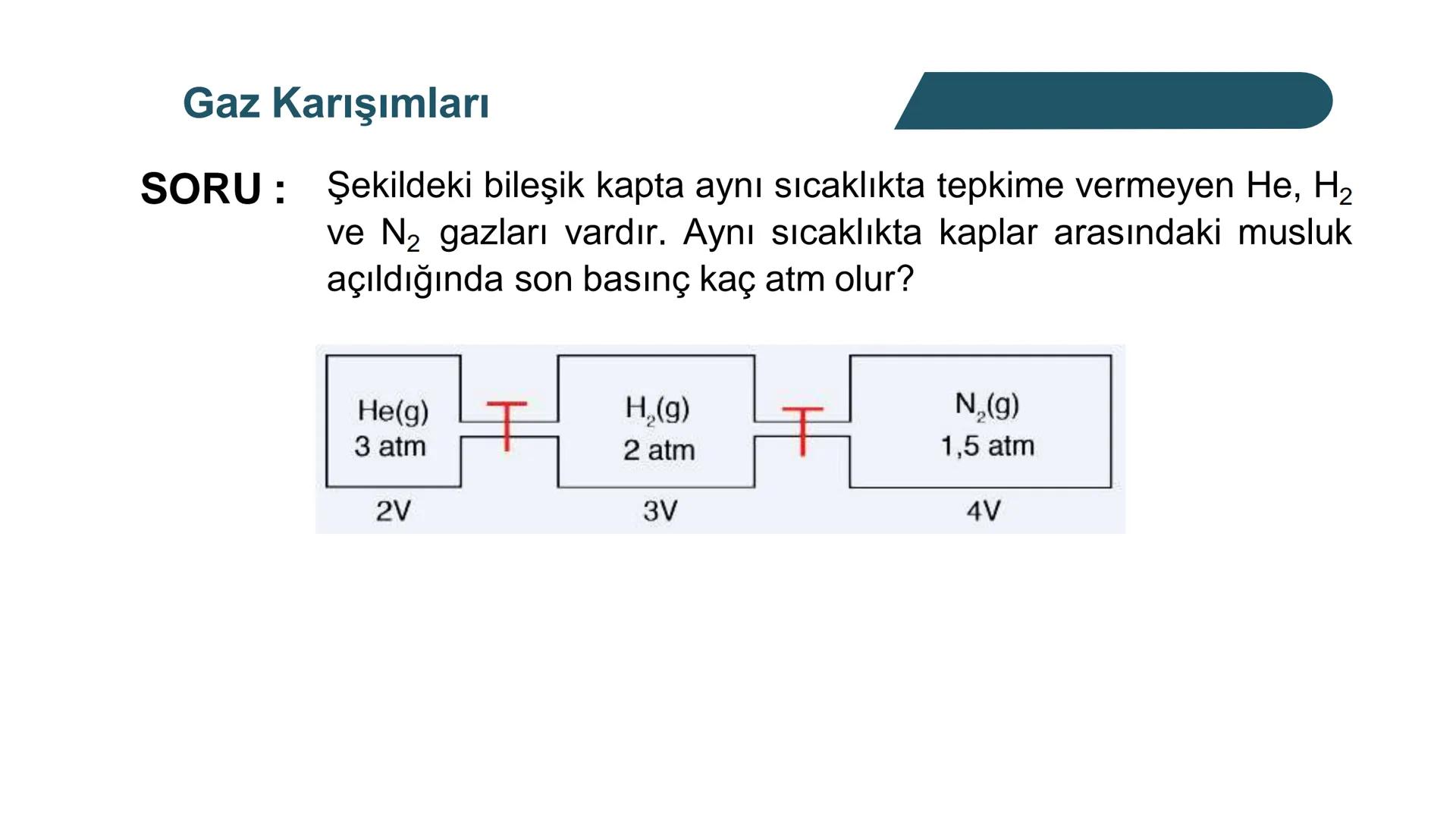
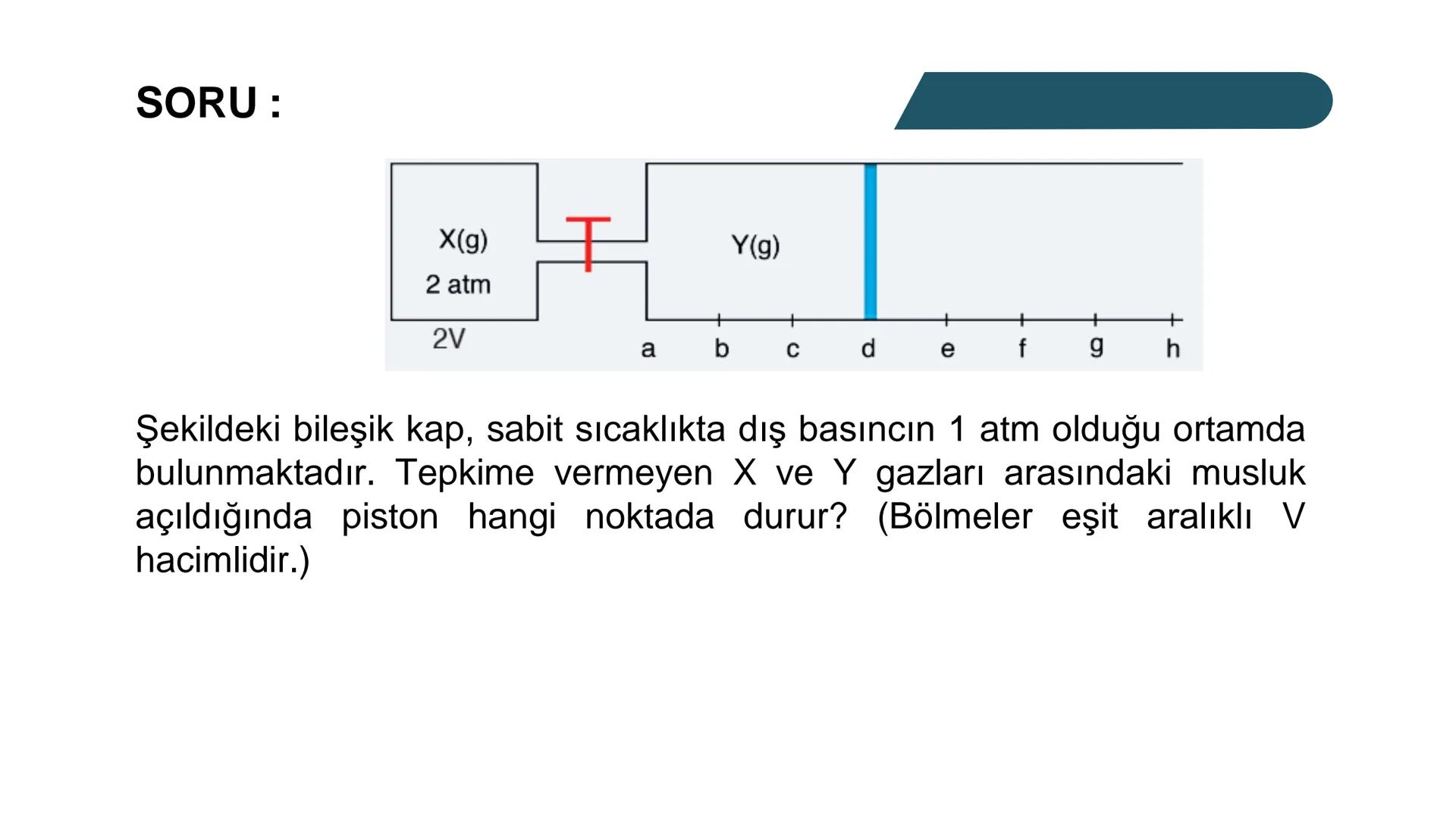
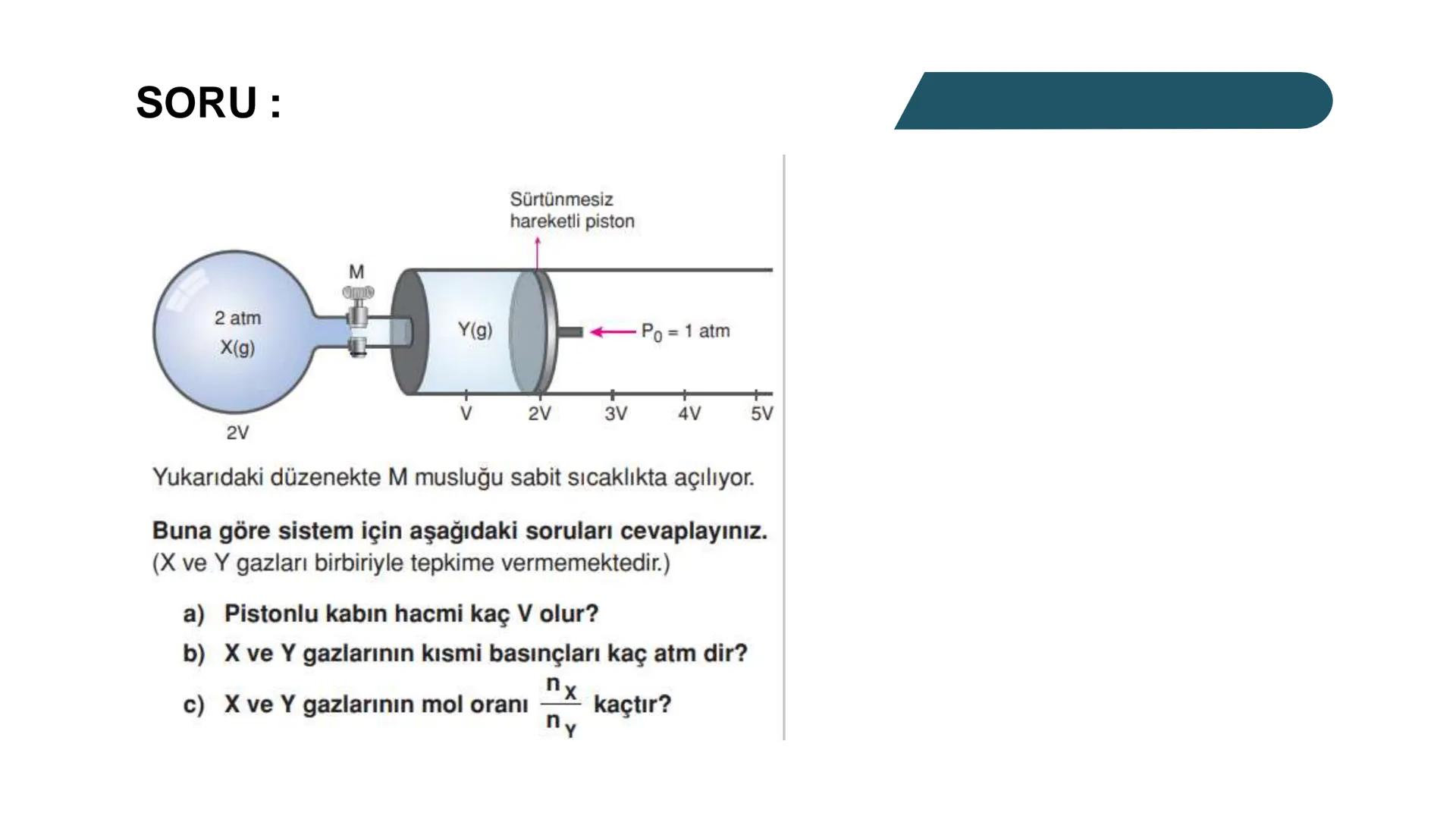
Kısmi Basınç Hesaplamaları
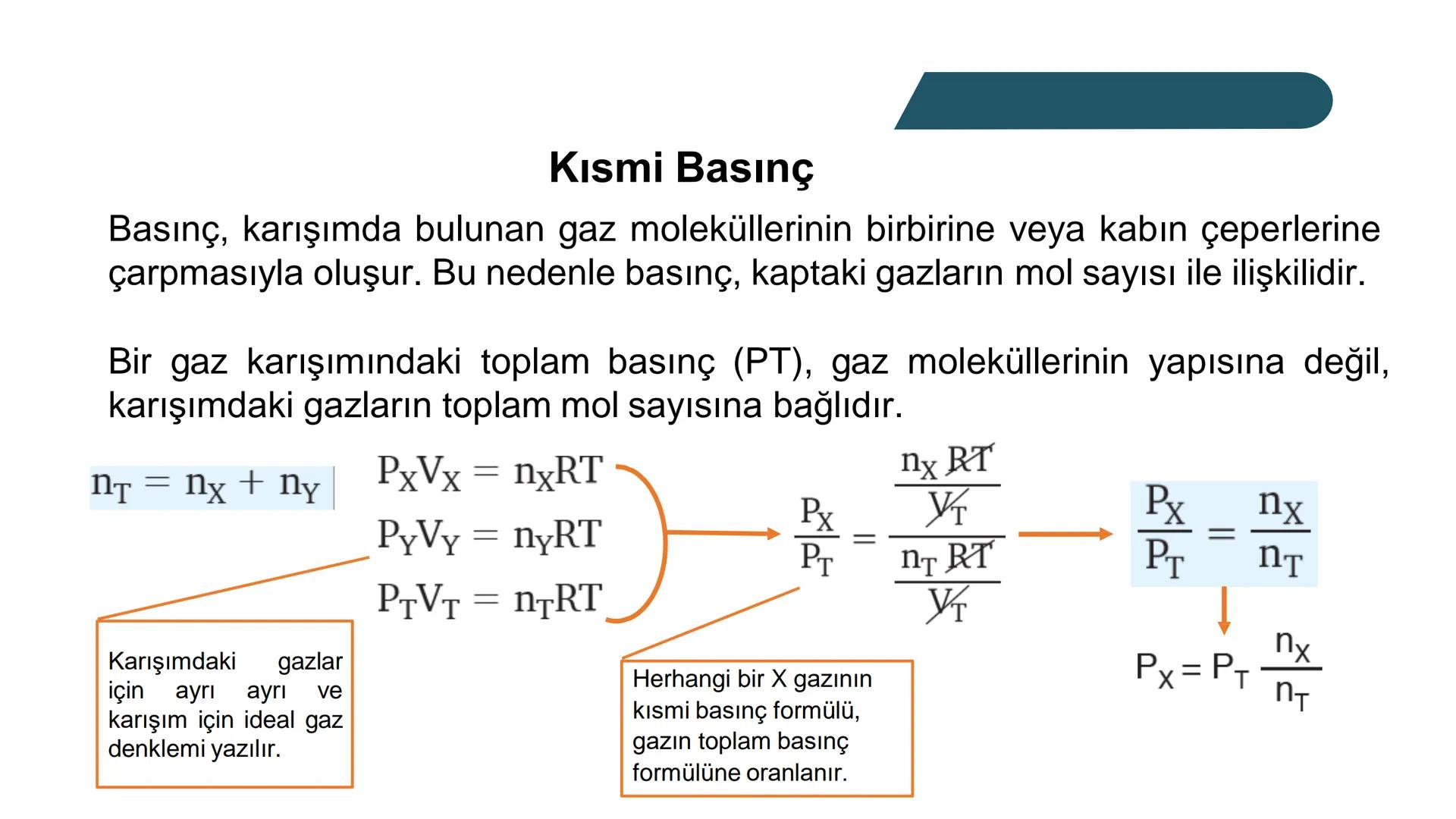
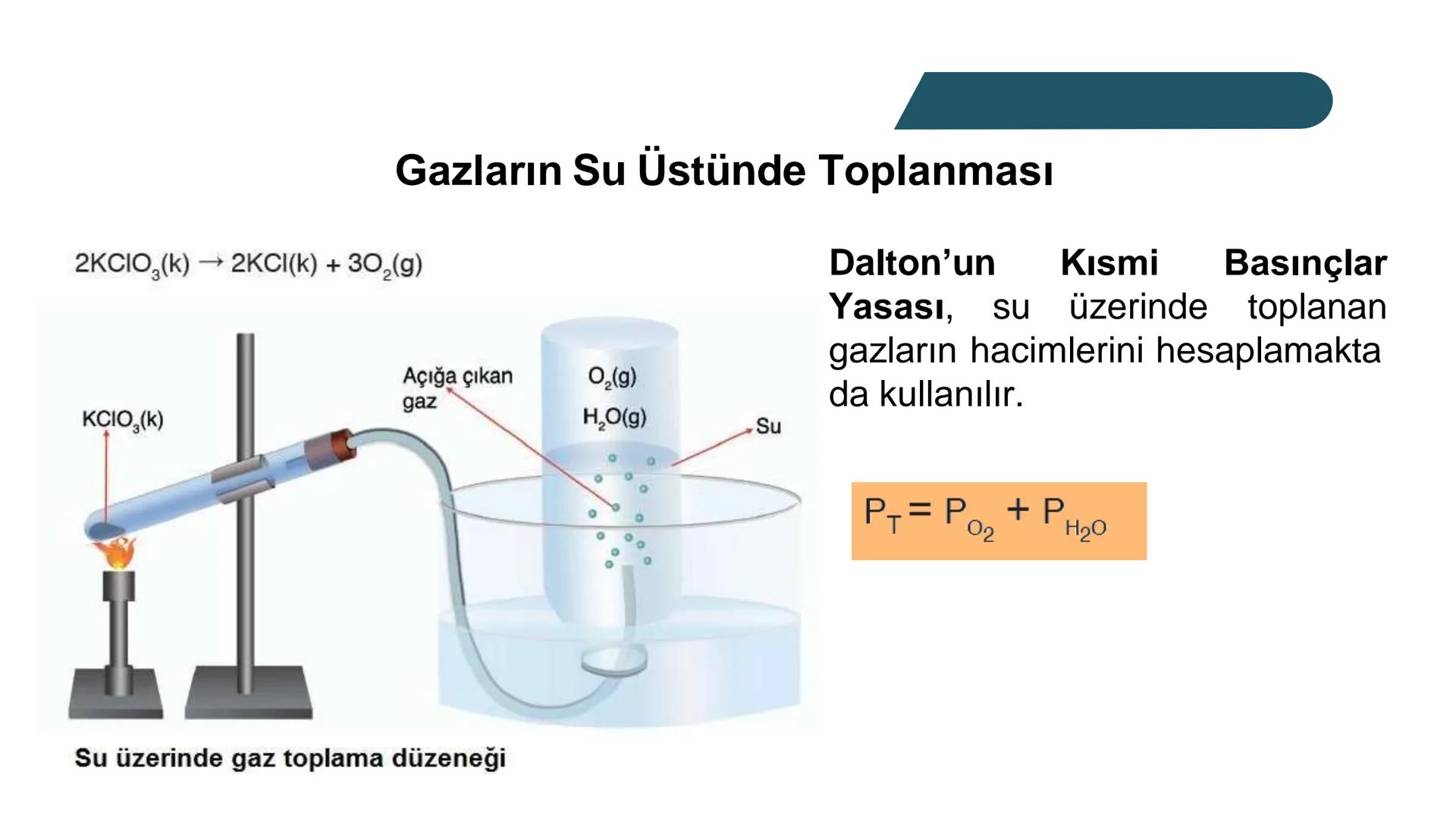
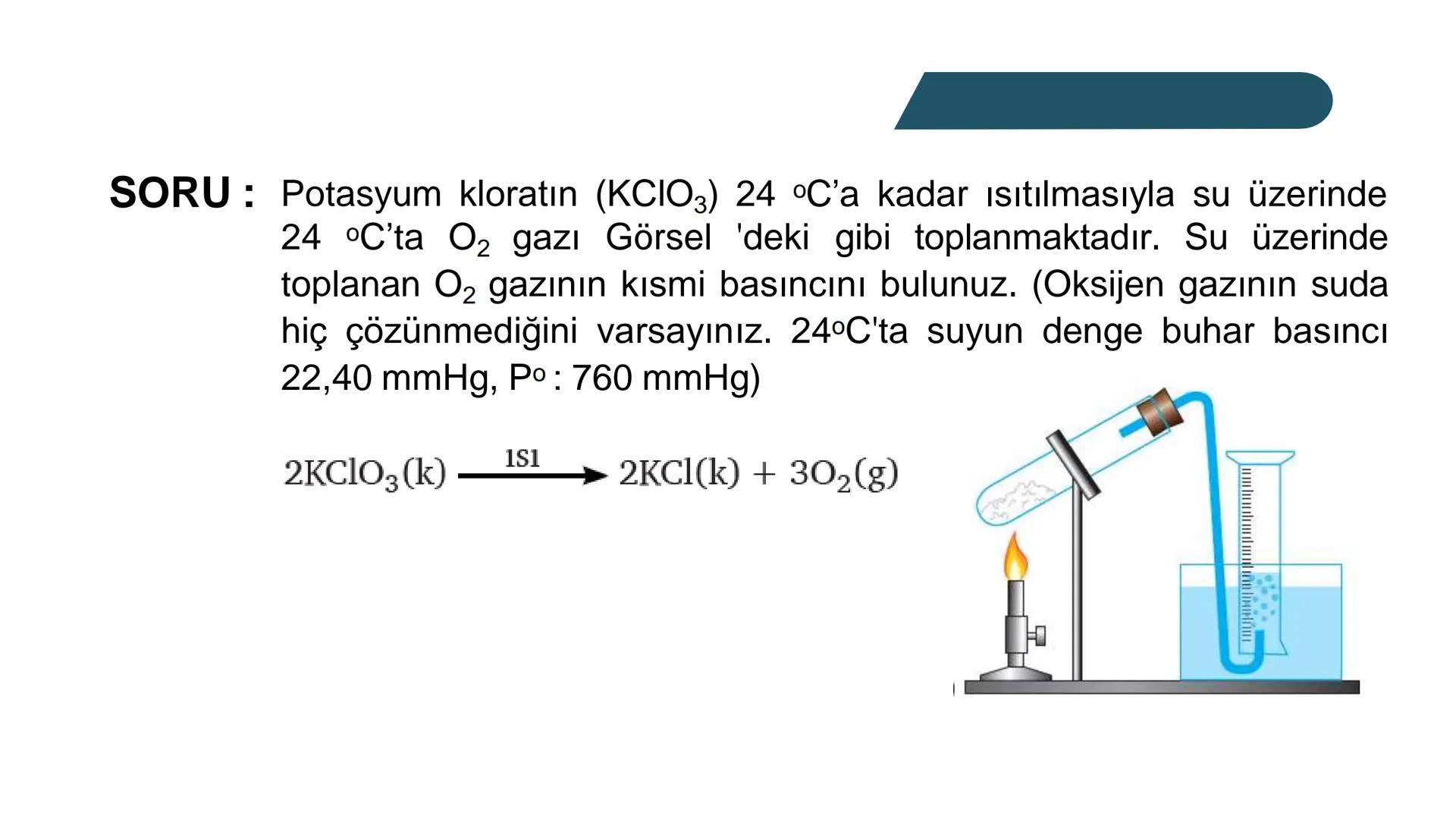
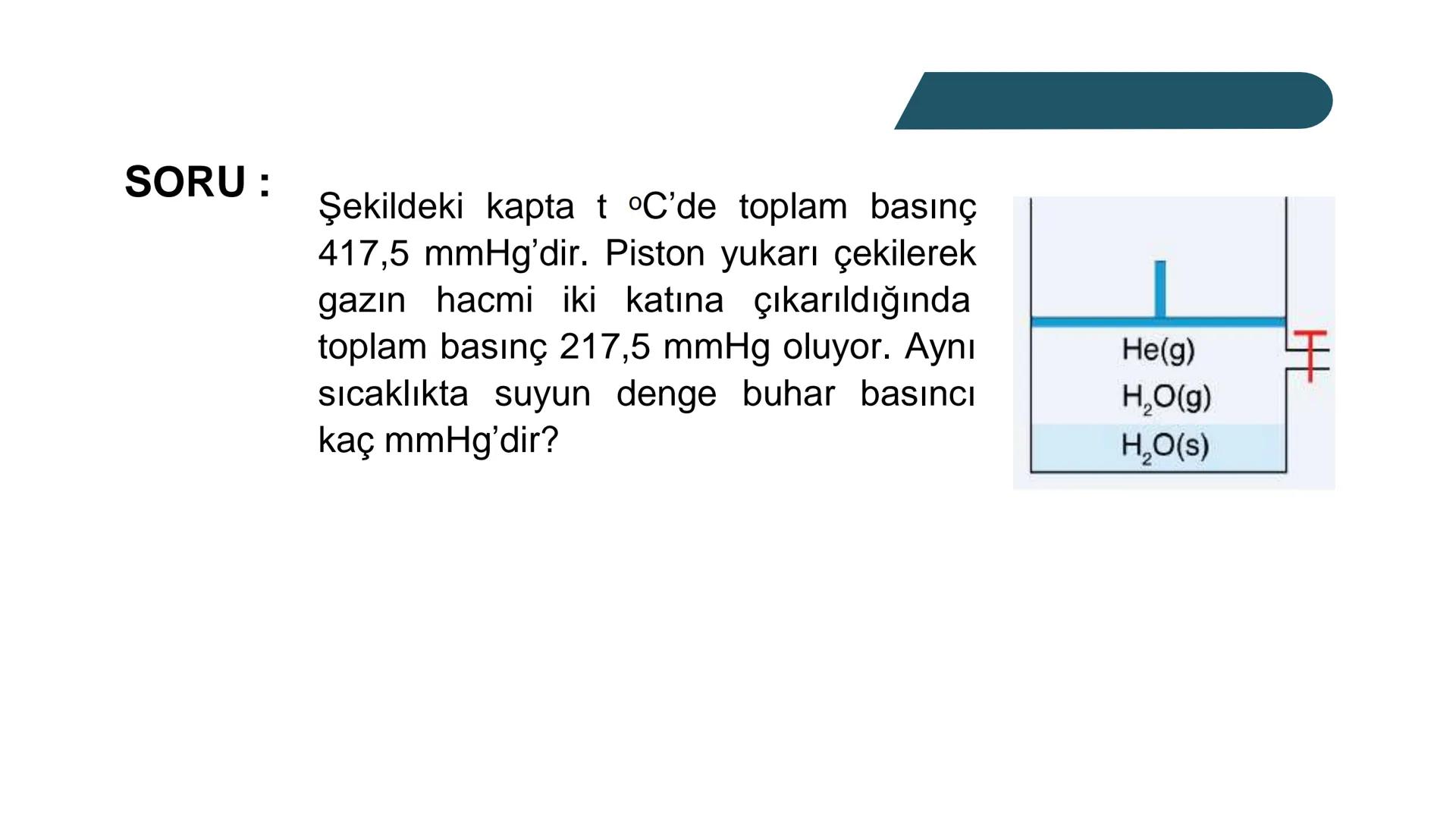
Bir gazın kısmi basıncı, o gazın molekül sayısıyla doğrudan ilişkilidir. Basınç, gaz moleküllerinin birbirine ve kabın çeperlerine çarpmasından kaynaklanır. Bu nedenle karışımdaki toplam basınç, gazların toplam mol sayısına bağlıdır.
Herhangi bir gazın kısmi basıncını hesaplamak için şu formülü kullanabiliriz:
PA = PT × nA/nT
Burada PA, A gazının kısmi basıncını; PT, toplam basıncı; nA, A gazının mol sayısını ve nT ise karışımdaki toplam mol sayısını gösterir.
Hatırlatma: İdeal gaz denklemi PV=nRT her bir gaz için ayrı ayrı ve karışım için de geçerlidir. Bu ilişkiyi kullanarak kısmi basınçları kolaylıkla hesaplayabilirsin.