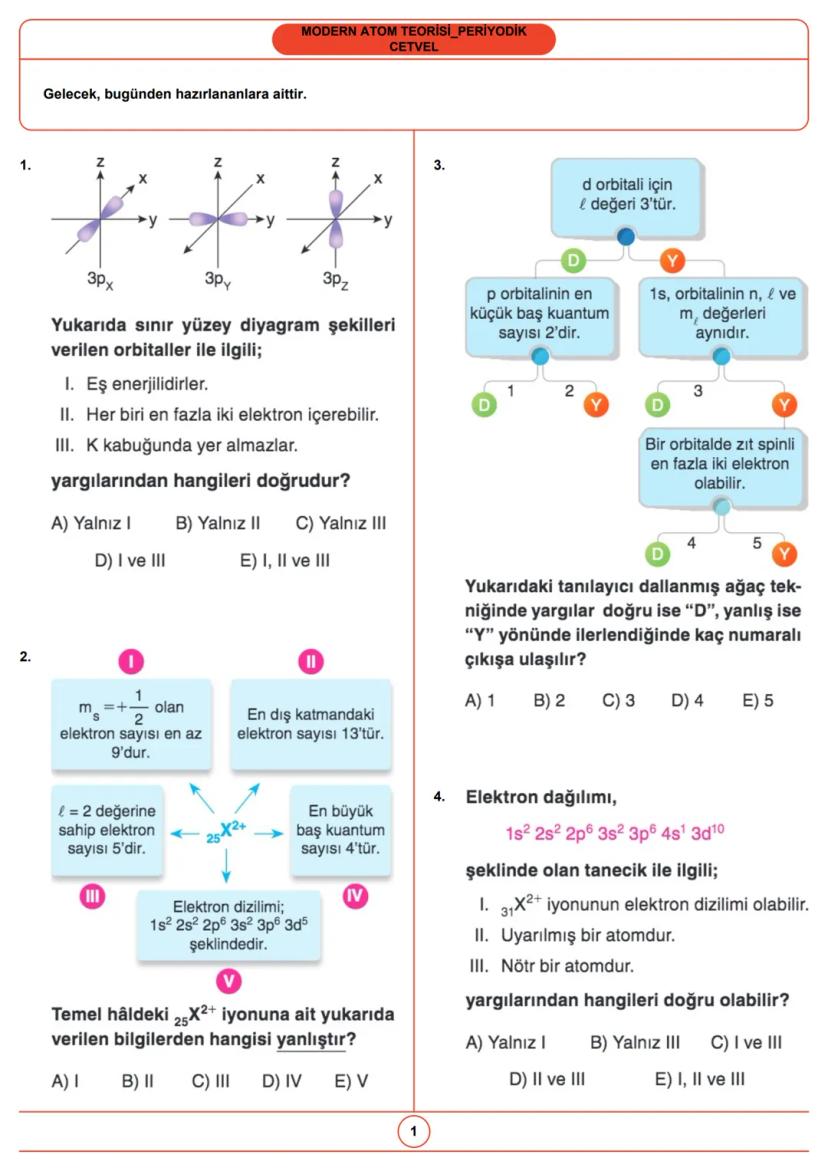
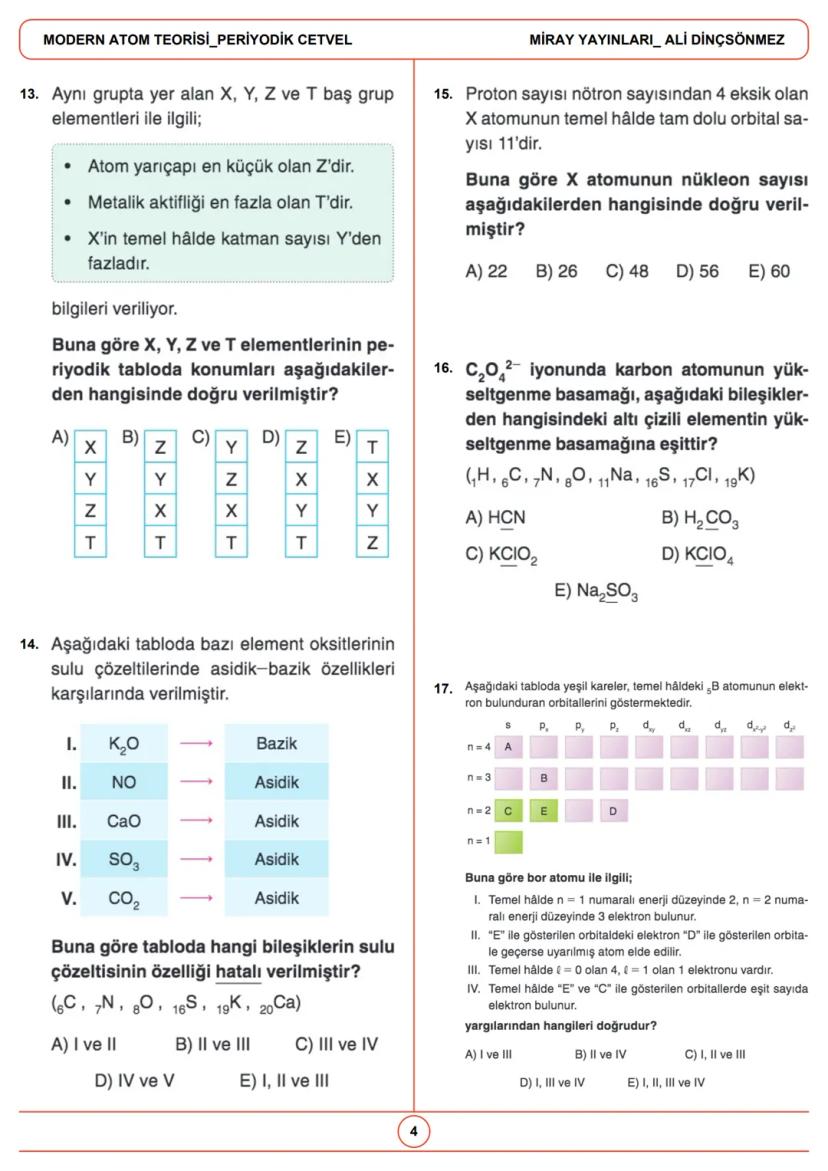
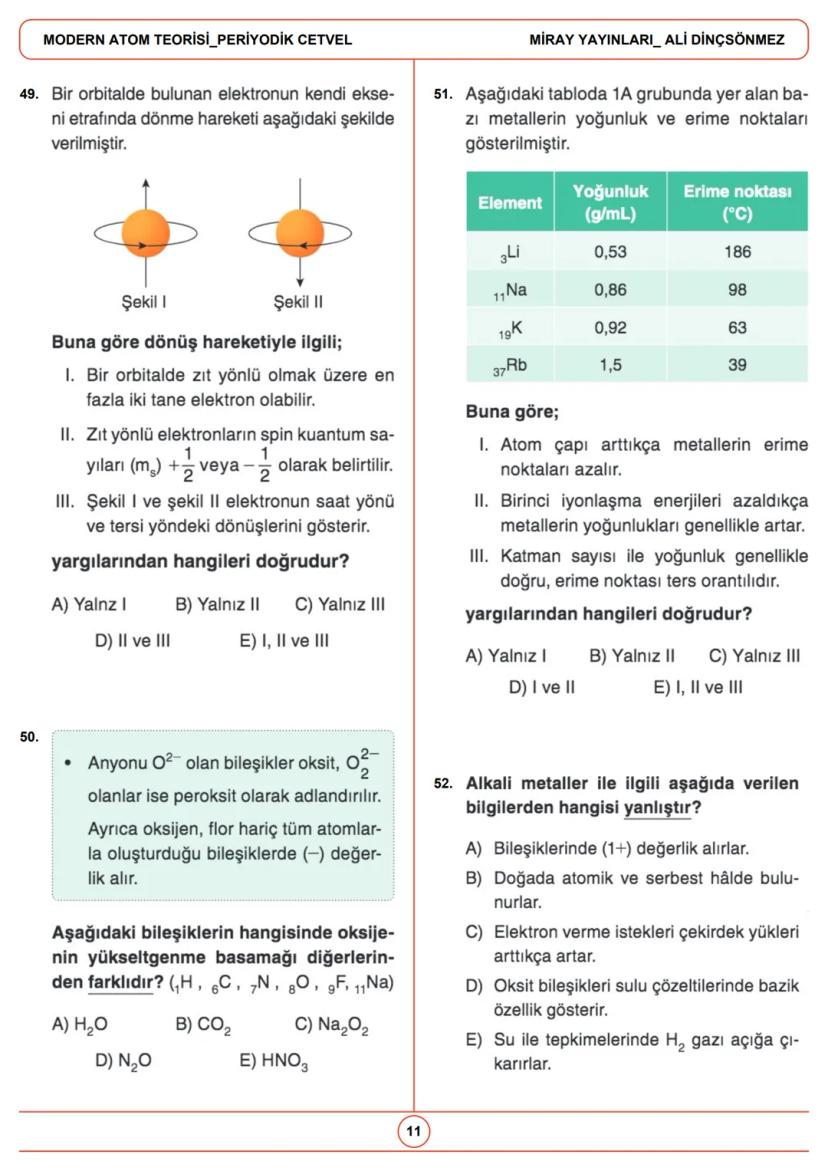
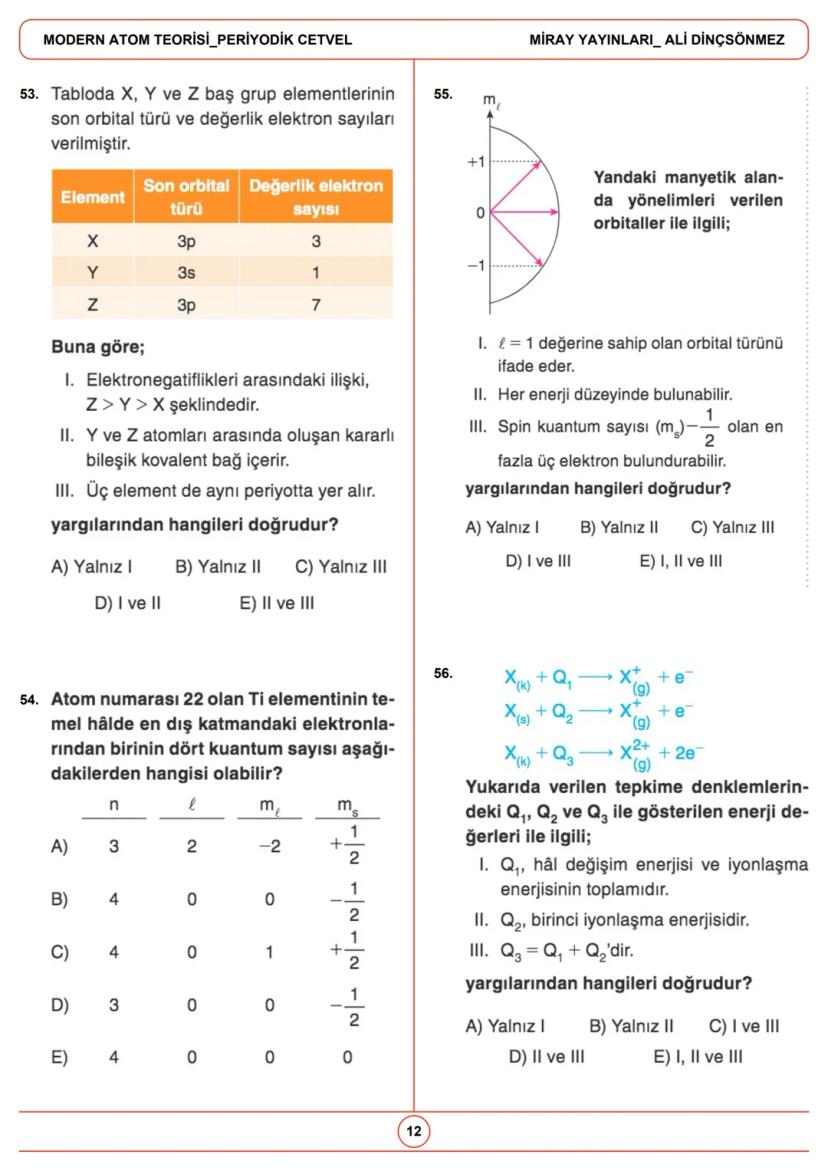
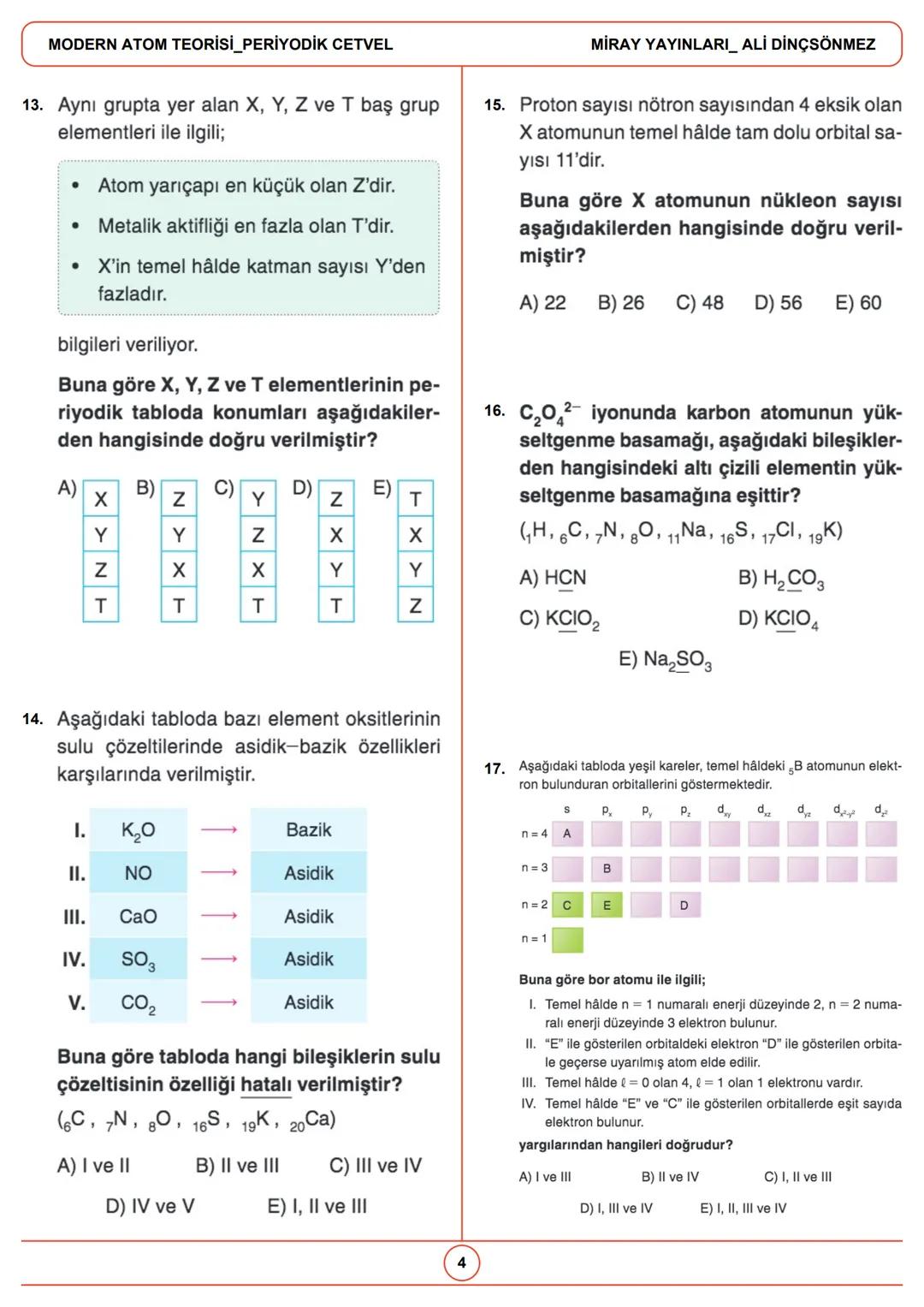
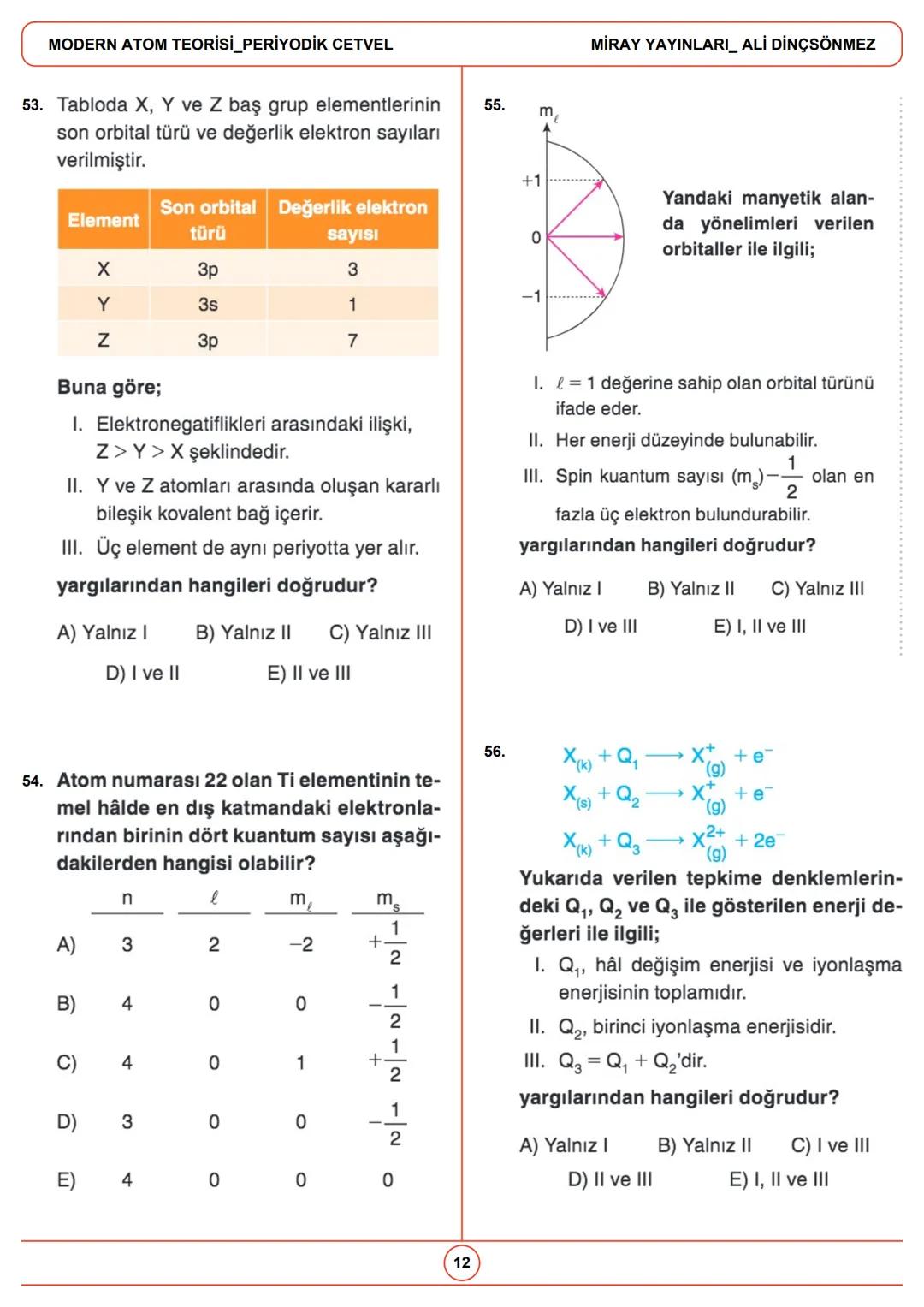
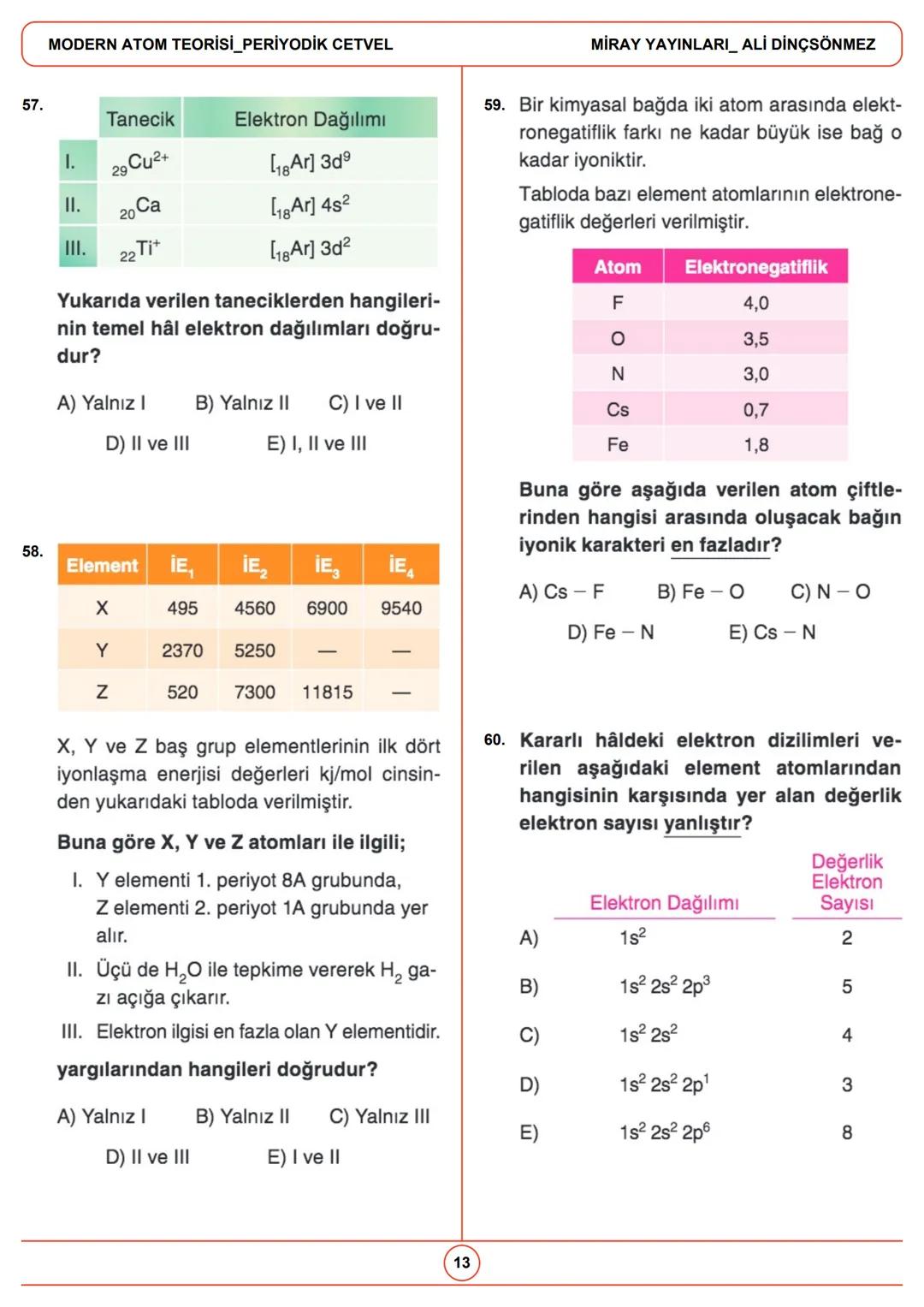
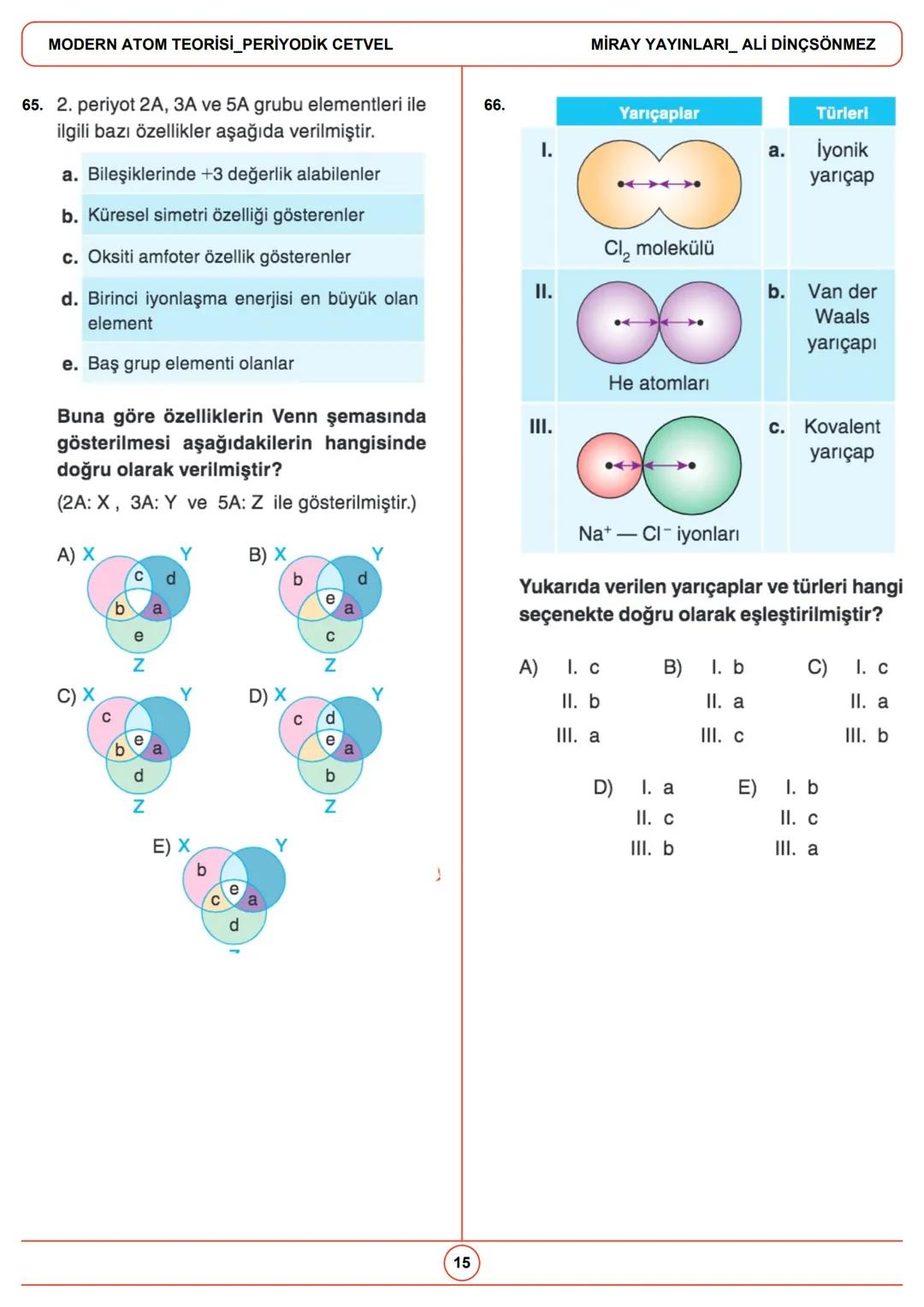
Modern Atom Modeli ve Periyodik Sistem
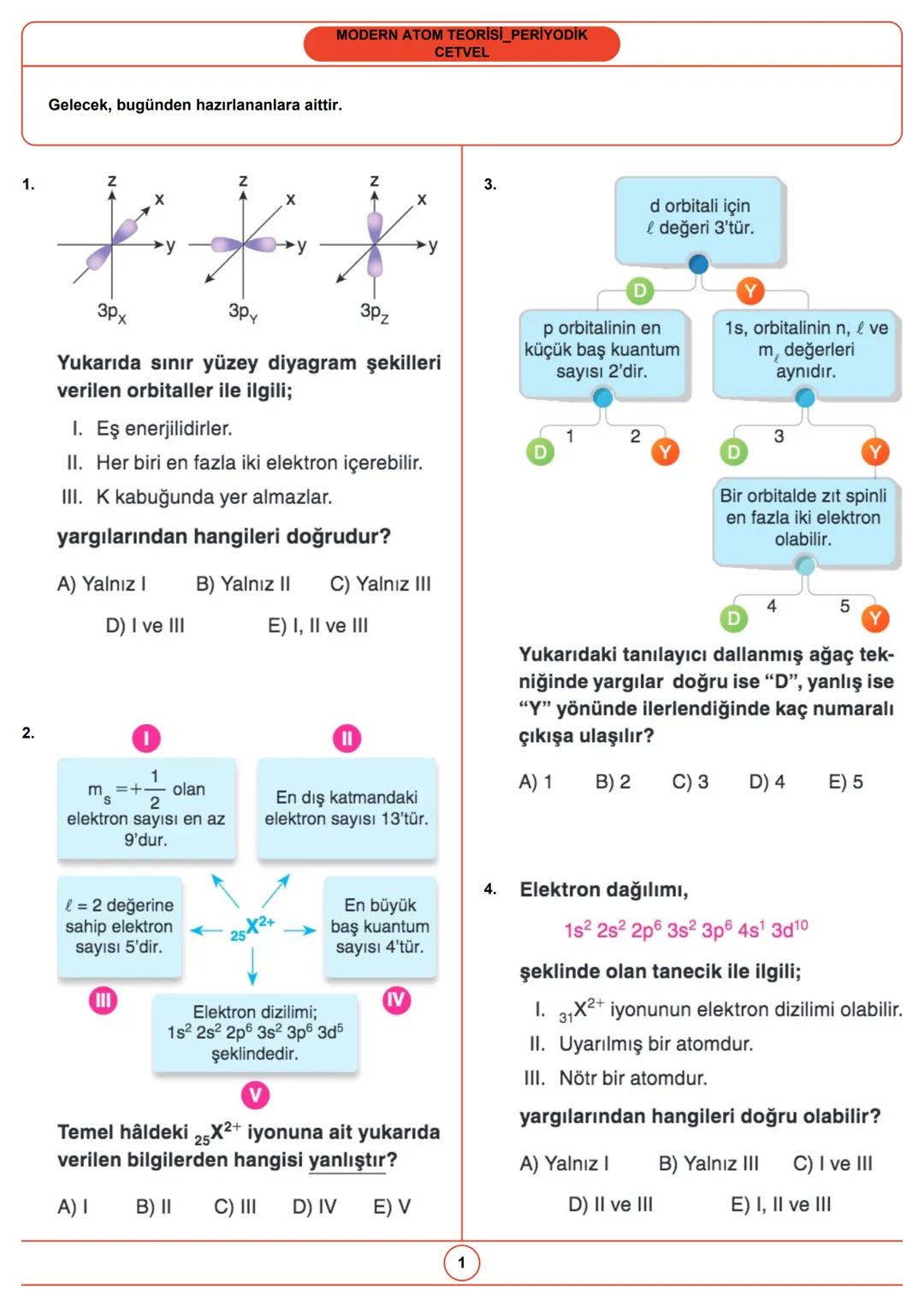
Modern atom modeline göre elektronlar, çekirdek etrafında belirli yörüngelerde değil orbitallerde bulunur. Bu model, elektronların bulunma olasılığını tanımlayan kuantum mekaniğine dayanır.
Periyodik tabloda elementler, atom numaralarının artışına göre sıralanır. Elementlerin kimyasal ve fiziksel özellikleri, periyodik olarak tekrarlanır. Periyodik tabloda:
- Periyotlar genellikle bir alkali metal ile başlar ve bir soygaz ile biter
- Grup elemanları benzer kimyasal özellikler gösterir
- Periyodik tabloda s, p, d ve f olmak üzere dört blok vardır
- IUPAC sistemine göre 18 grup vardır
Aynı periyotta, atom numarası arttıkça atom yarıçapı azalır. Bunun nedeni, artan çekirdek yükünün elektronları daha kuvvetli çekmesidir. Örneğin, 3. periyottaki Na, Mg, Al, Si, P, S ve Cl elementlerinde atom yarıçapı Na'dan Cl'ye doğru azalır.
💡 Dikkat: Elektronlar, atomda Aufbau (artan enerji) ilkesi, Hund kuralı ve Pauli dışlama ilkesine göre yerleşir.
Bir atomun uyarılmış hâli, temel hâle göre daha yüksek enerjilidir ve daha kararsızdır. Uyarılmış hâldeki atom, enerjisini kaybederek temel hâle dönme eğilimindedir.