Periyodik Tablonun Blok Yapısı
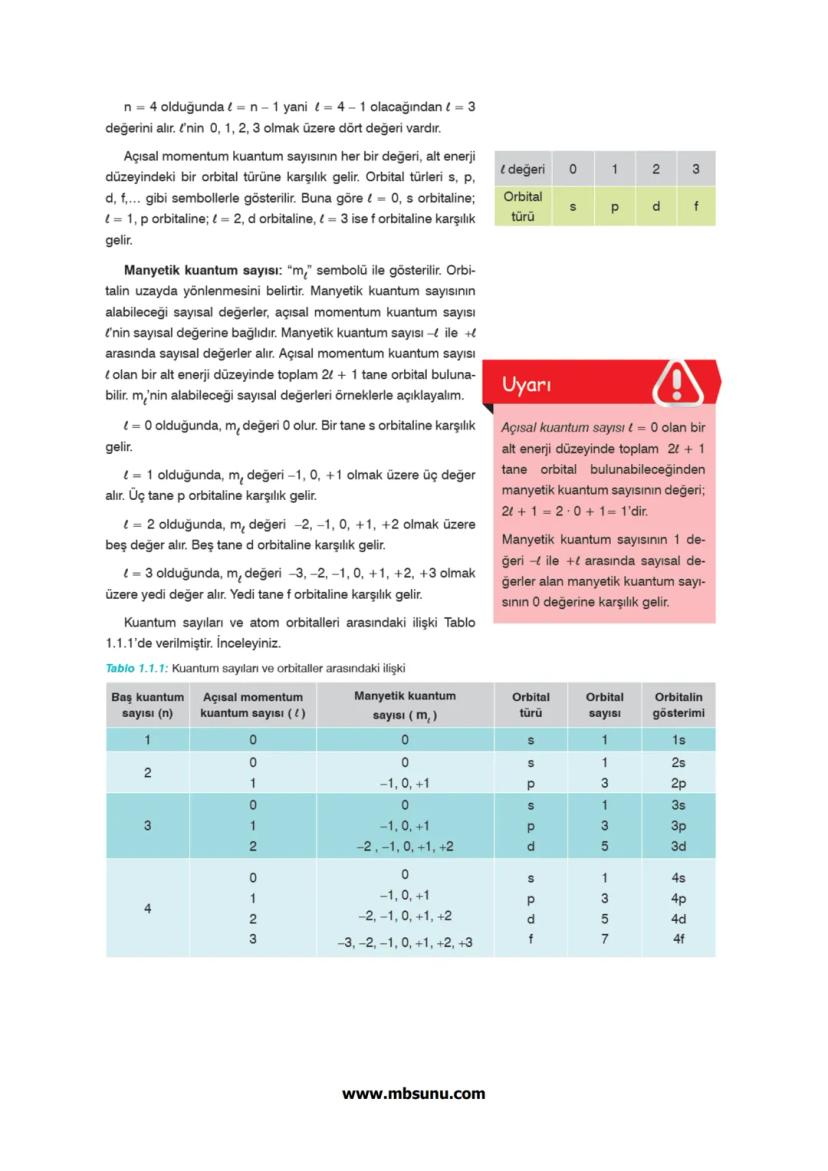
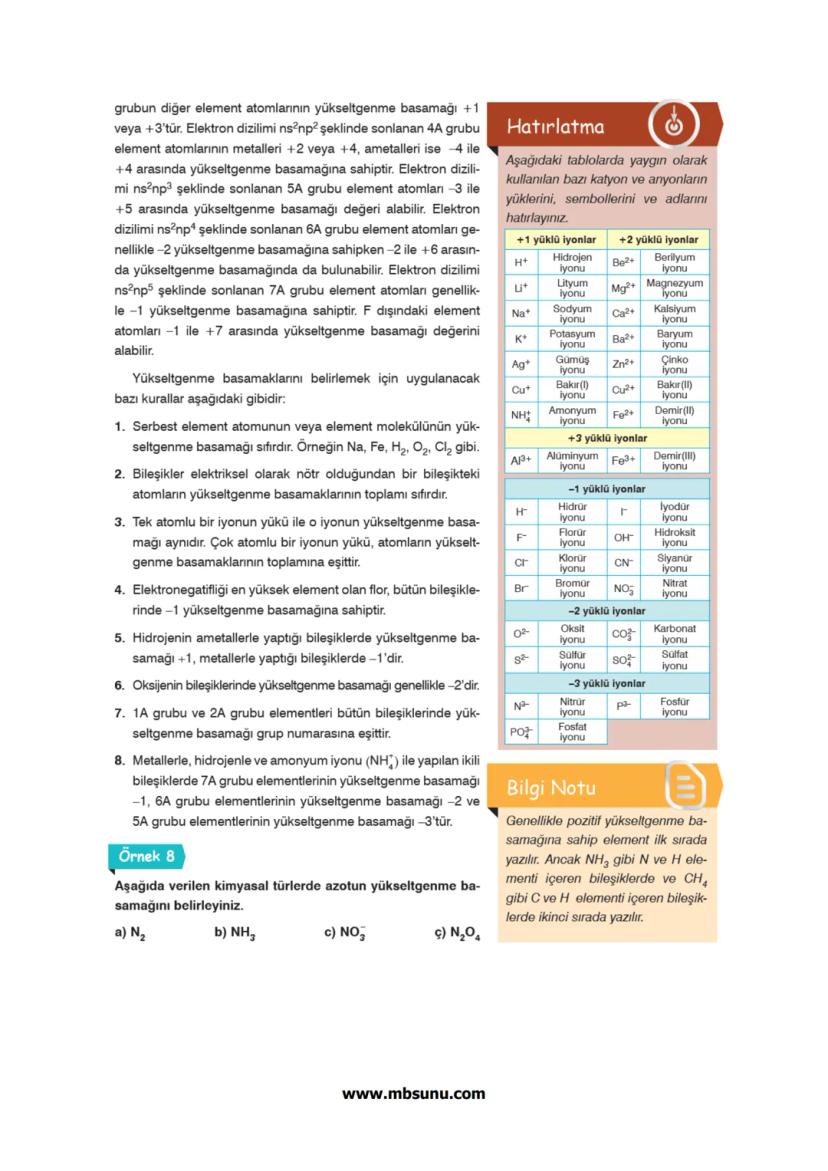
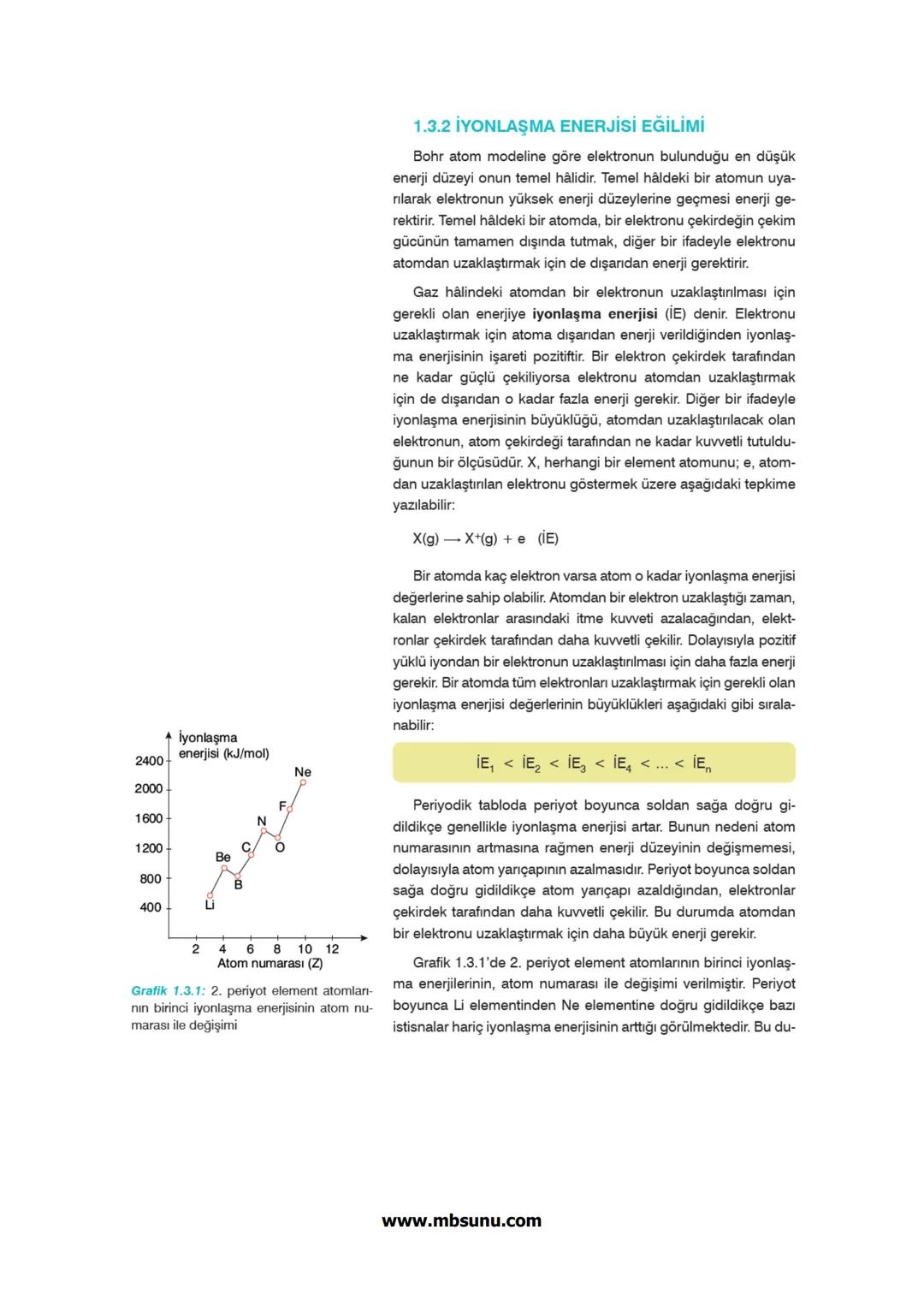
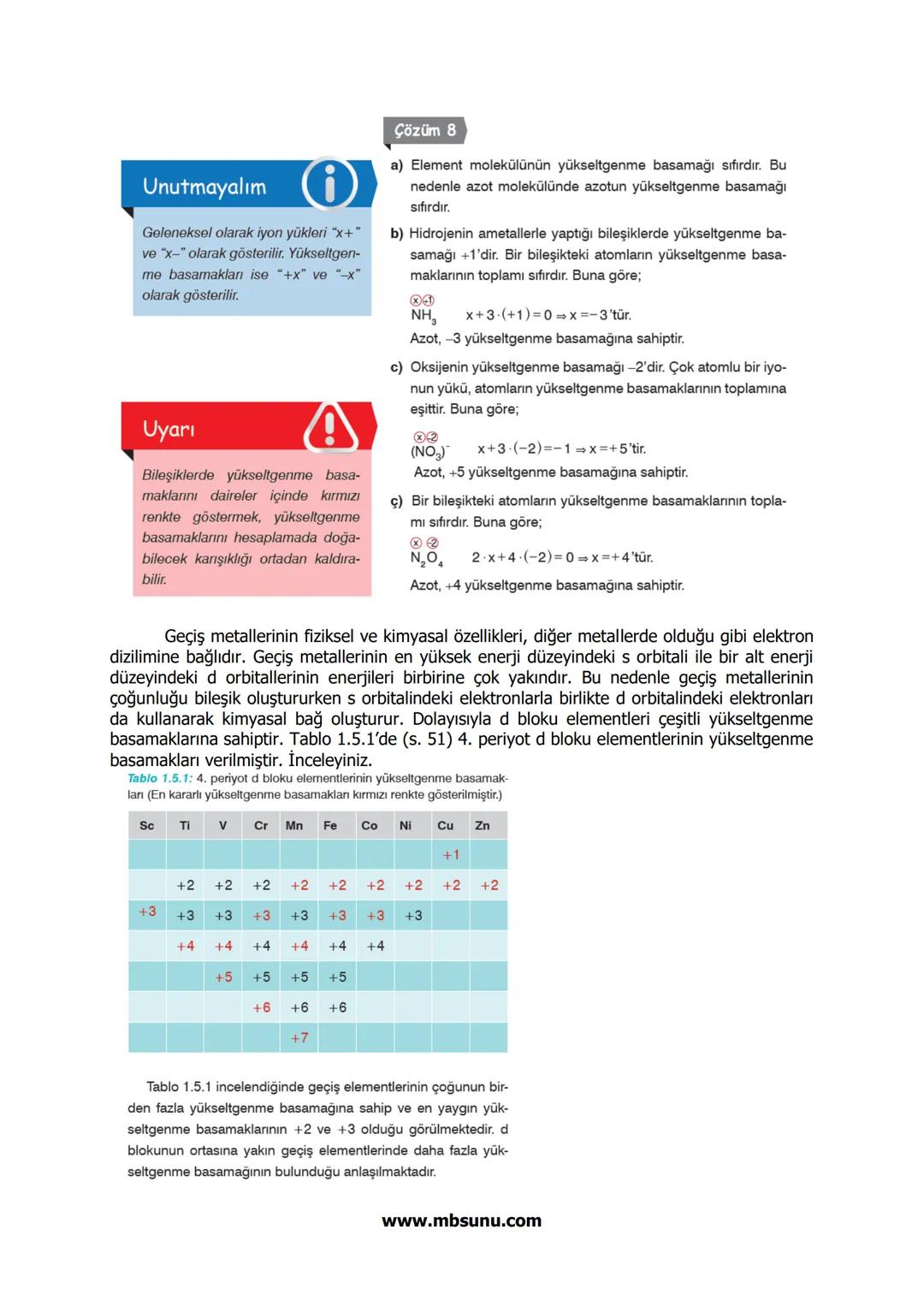
Periyodik tablo dört ana bloktan oluşur: s, p, d ve f blokları. Her blok, elektronların son yerleştiği orbital türüne göre adlandırılır.
s bloku: 1A ve 2A grupları 1−2elektron
p bloku: 3A-8A grupları 1−6elektron
d bloku: B grupları 1−10elektron
f bloku: Lantanitler ve aktanitler 1−14elektron
Aufbau Prensibi elektronların orbitallere yerleşme sırasını belirler: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Bu sıraya göre her enerji düzeyinin alabileceği maksimum elektron sayısı 2n² formülü ile hesaplanır. Örneğin n=2 için 2×2²=8 elektron.
Pratik Not: Elektronların orbitallere dağılımını ezberlemek yerine, periyodik tablonun blok yapısını kullanarak kolayca bulabilirsin.