Asidik ve Bazik Özellikler
Asit: Suda çözündüğünde H⁺ iyonu veren maddelerdir.
Baz: Suda çözündüğünde OH⁻ iyonu veren maddelerdir.
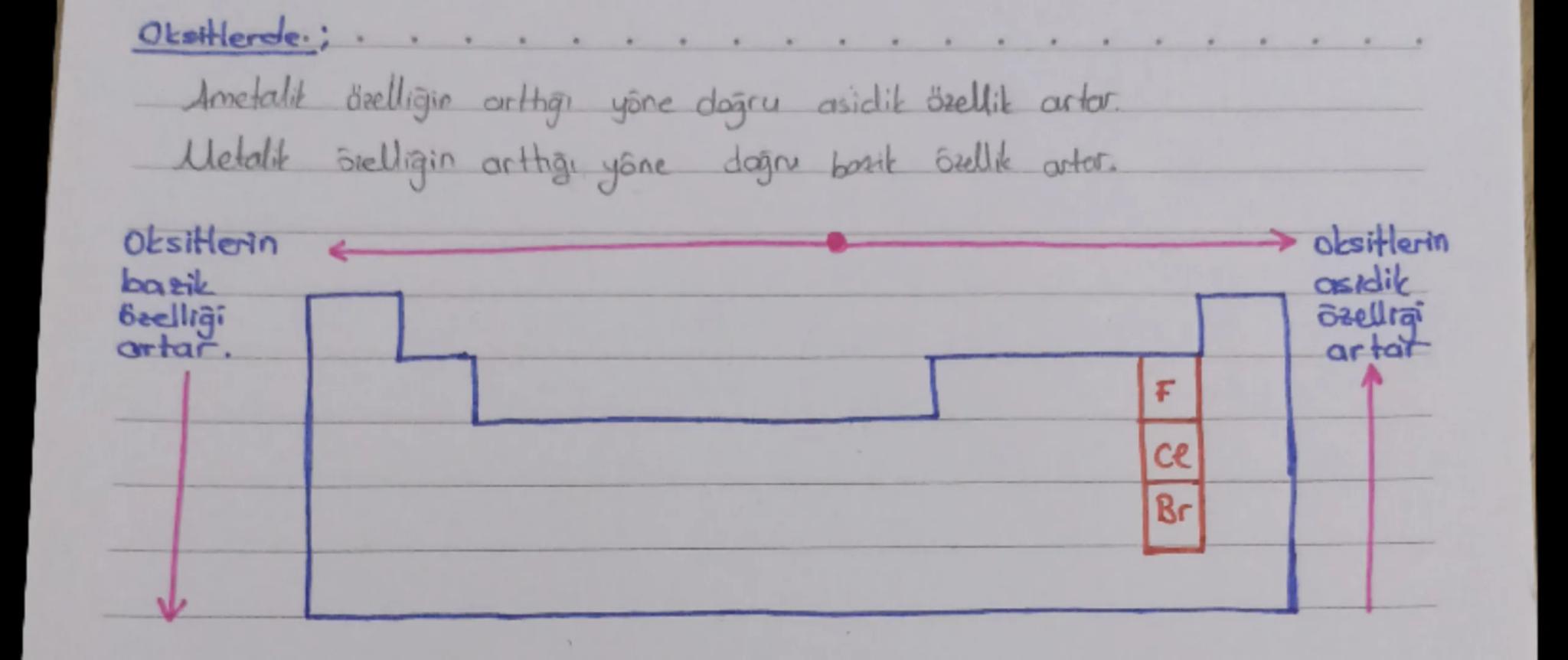
Oksit: OF₂ birleşiği dışında diğer elementlerin oksijen ile yaptığı bileşiklere oksit denir.
Oksitler üç gruba ayrılır:
- Metal Oksitler: Bazik özellik gösterir (Na₂O, MgO)
- Ametal Oksitler: Asidik özellik gösterir (SO₃, P₂O₅)
- Nötr Oksitler: Ametal sayısı oksijen sayısına eşit veya az ise nötr özellik gösterir (CO, N₂O)
Amfoter metaller (Al, Sn, Pb, Zn, Cr, Be) hem asidik hem de bazik özellik gösterebilir.
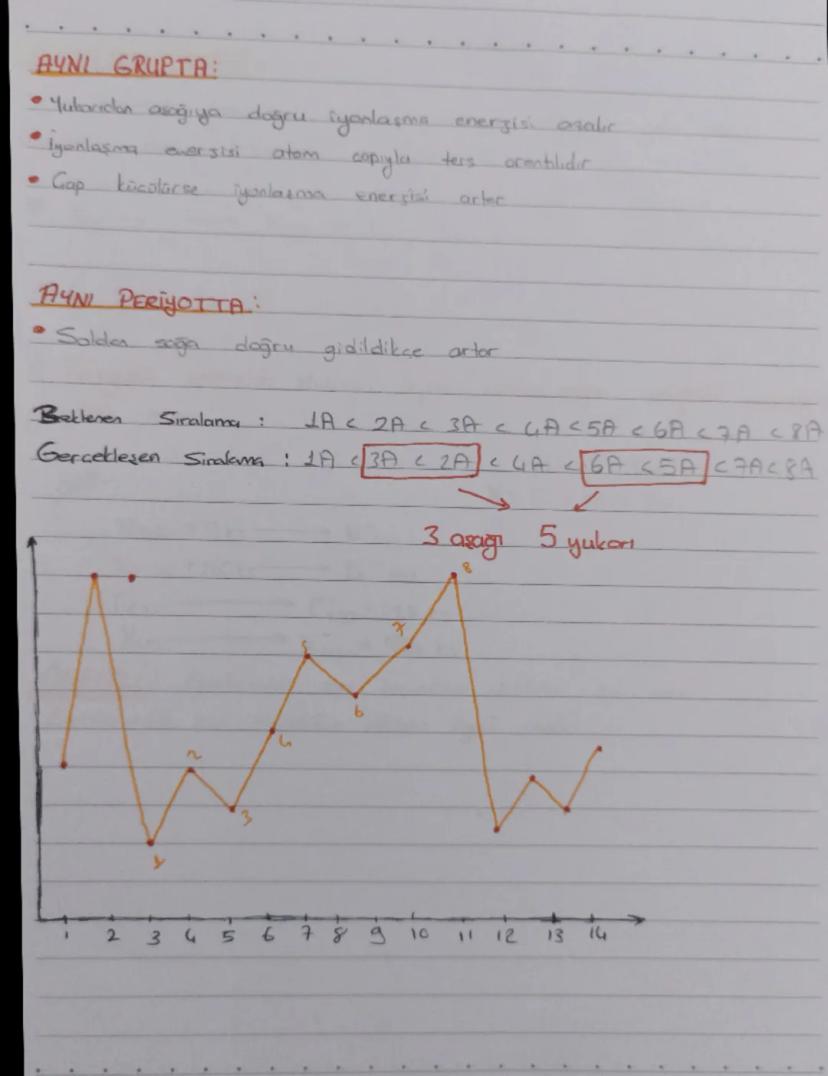
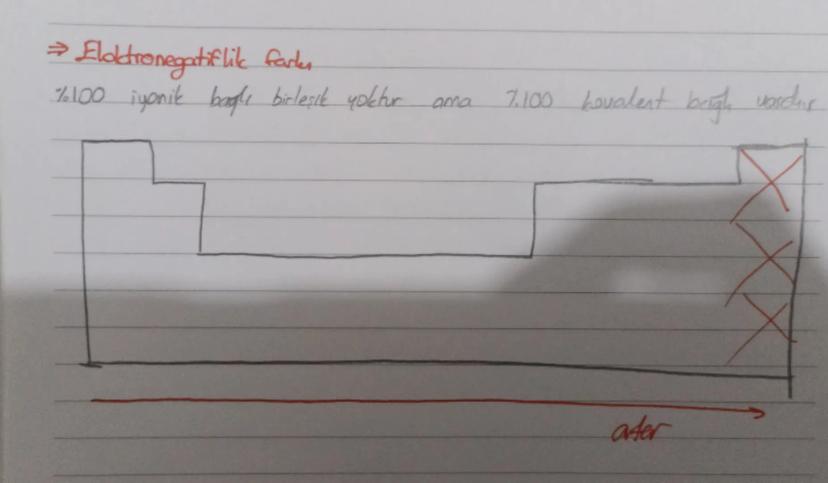
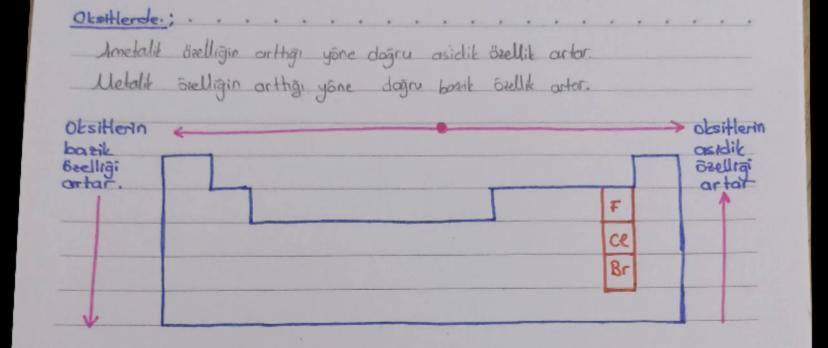
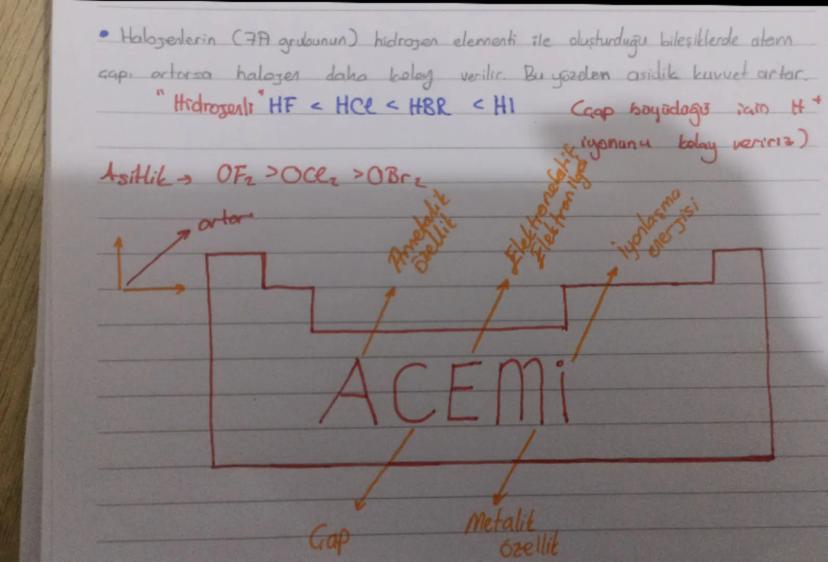
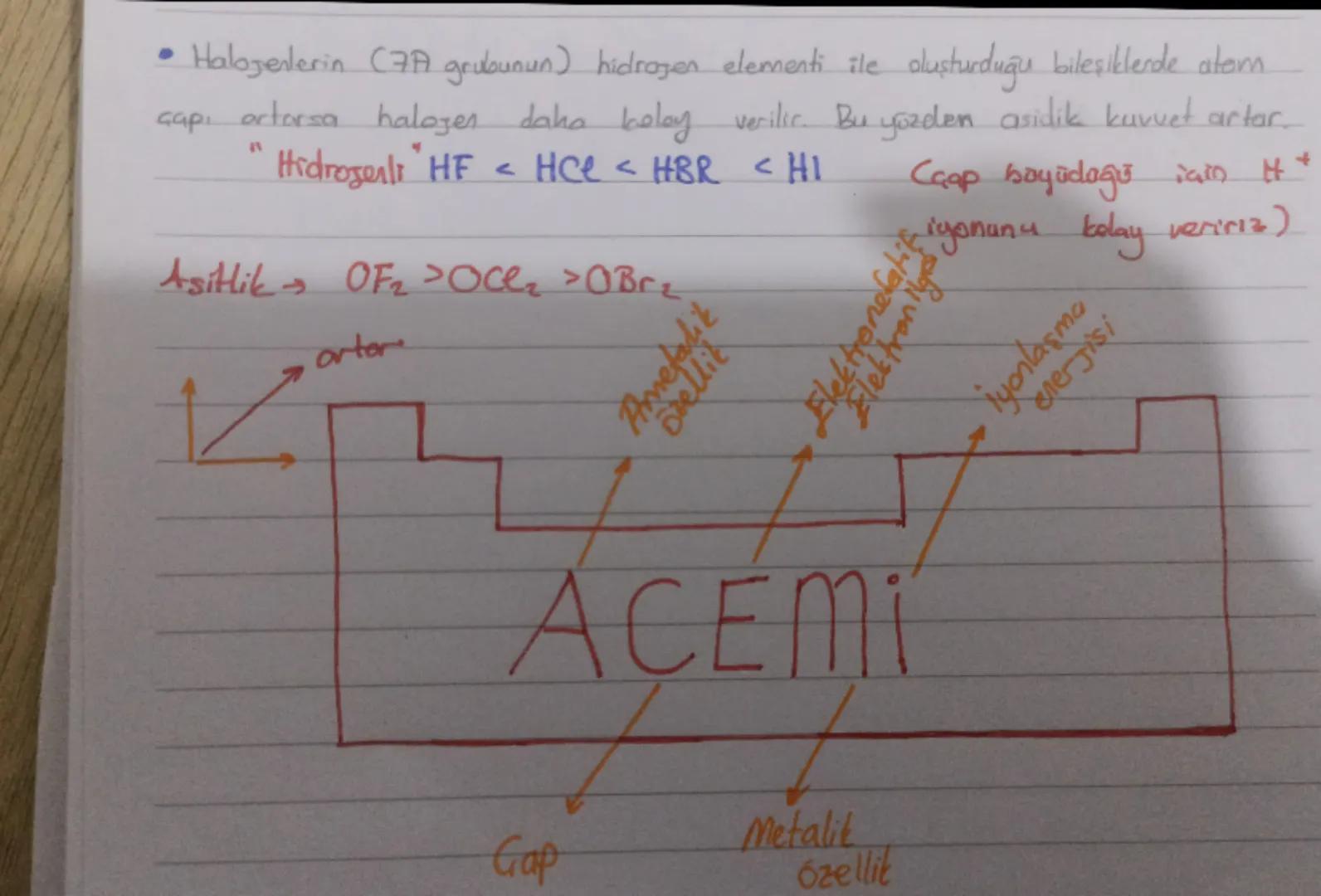
💡 Pratik bilgi: Oksitlerde ametalik özelliğin arttığı yöne doğru asidik özellik, metalik özelliğin arttığı yöne doğru bazik özellik artar. Periyodik tabloda sağa ve yukarı gidildikçe oksitlerin asitliği artar.