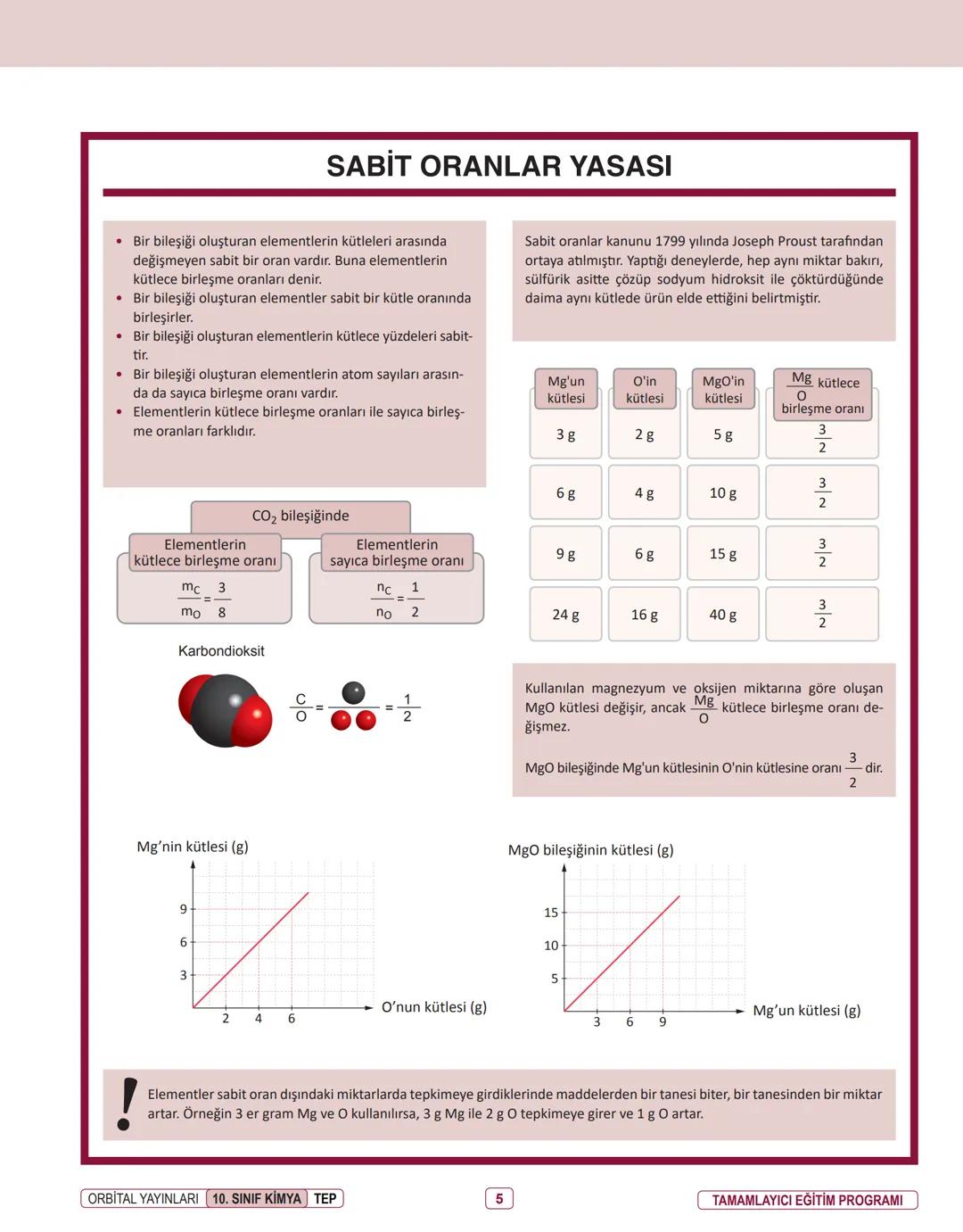
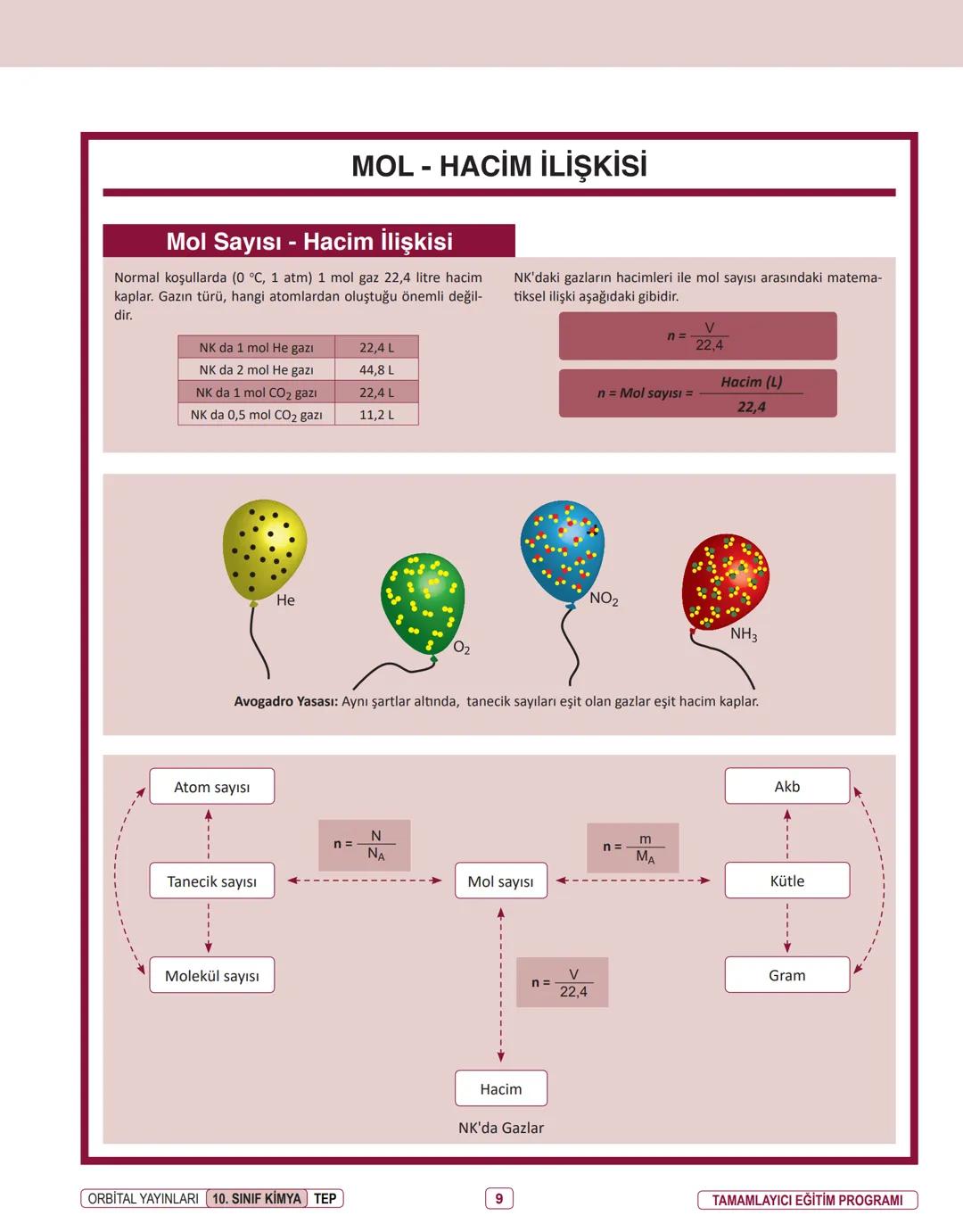
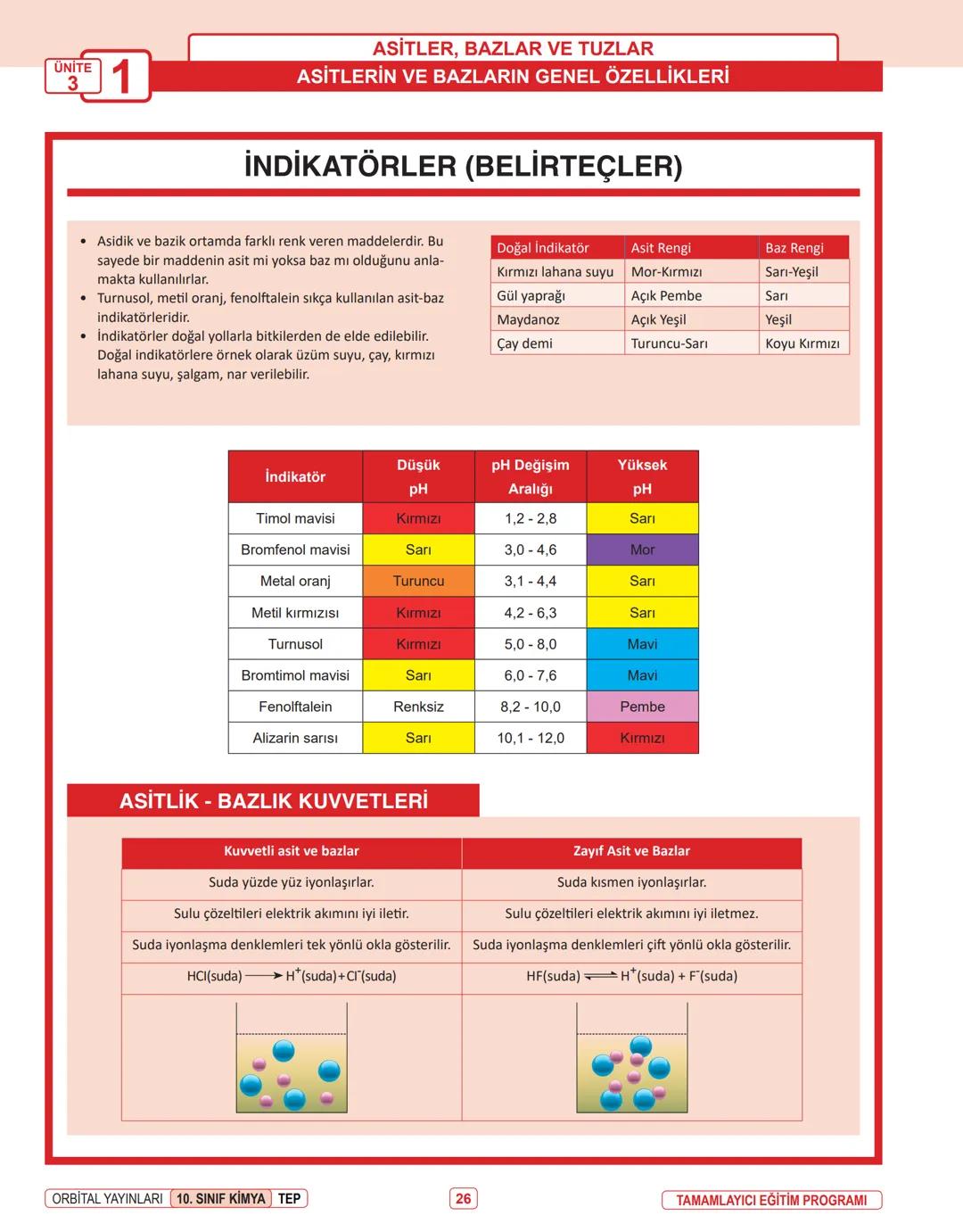
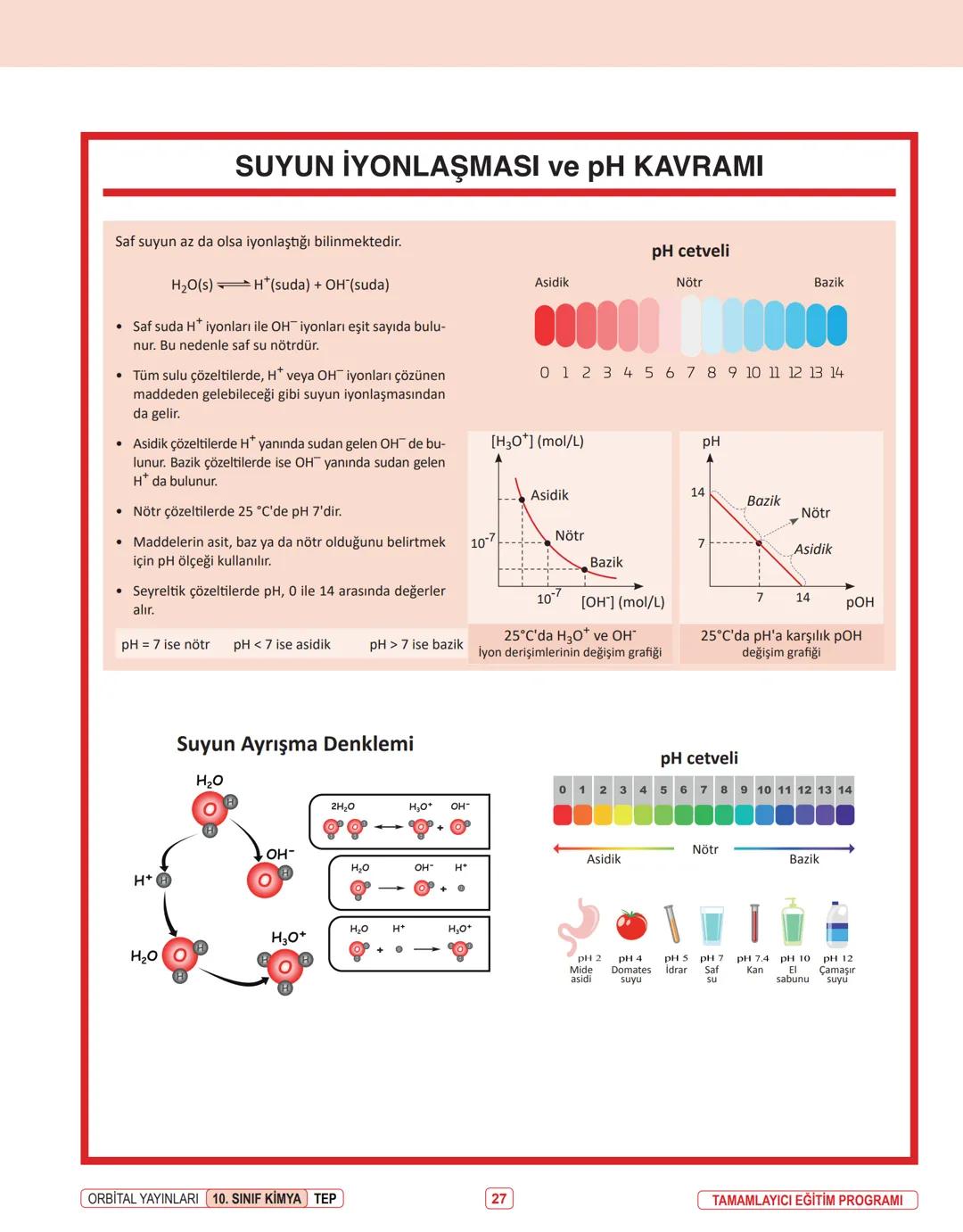
Kimyasal Tepkime Türleri ve Denkleştirme
Kimyasal tepkimeleri daha iyi anlamak için, farklı tepkime türlerini bilmek ve denklemleri doğru yazmak önemlidir.
Yanma Tepkimeleri:
Bir maddenin oksijen (O₂) ile verdiği tepkimedir. Metaller, ametaller veya bileşikler yanma tepkimesi verebilir.
- Metal yanması: 2Fe(k) + 3/2O₂(g) → Fe₂O₃(k)
- Ametal yanması: C(k) + O₂(g) → CO₂(g)
- Bileşik yanması: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Yanma tepkimesi için üç şart gereklidir: oksijen, yanacak madde ve tutuşma sıcaklığı. Azot gazının yanması hariç, tüm yanma tepkimeleri ısı açığa çıkarır (ekzotermik).
Asit-Baz Tepkimeleri:
Asitler H⁺ iyonu verirken, bazlar OH⁻ iyonu verir. Bir asit ile baz karşılaştığında, H⁺ ve OH⁻ iyonları birleşerek su oluşturur ve geriye tuz kalır.
Asit + Baz → Tuz + Su
Örnek: HNO₃ + NaOH → NaNO₃ + H₂O
Çözünme-Çökelme Tepkimeleri:
Suda iyi çözünen iki farklı tuzun çözeltileri karıştırıldığında, suda az çözünen yeni bir tuz oluşabilir.
AgNO₃(suda) + NaCl(suda) → AgCl(k) + NaNO₃(suda)
Net İyon Denklemi: Çökelme tepkimelerinde, çözeltide kalan iyonlar "seyirci iyonlar" olarak adlandırılır. Gerçekte tepkimeye giren iyonlar arasındaki denkleme "net iyon denklemi" denir. Örneğin: Ag⁺(suda) + Cl⁻(suda) → AgCl(k)