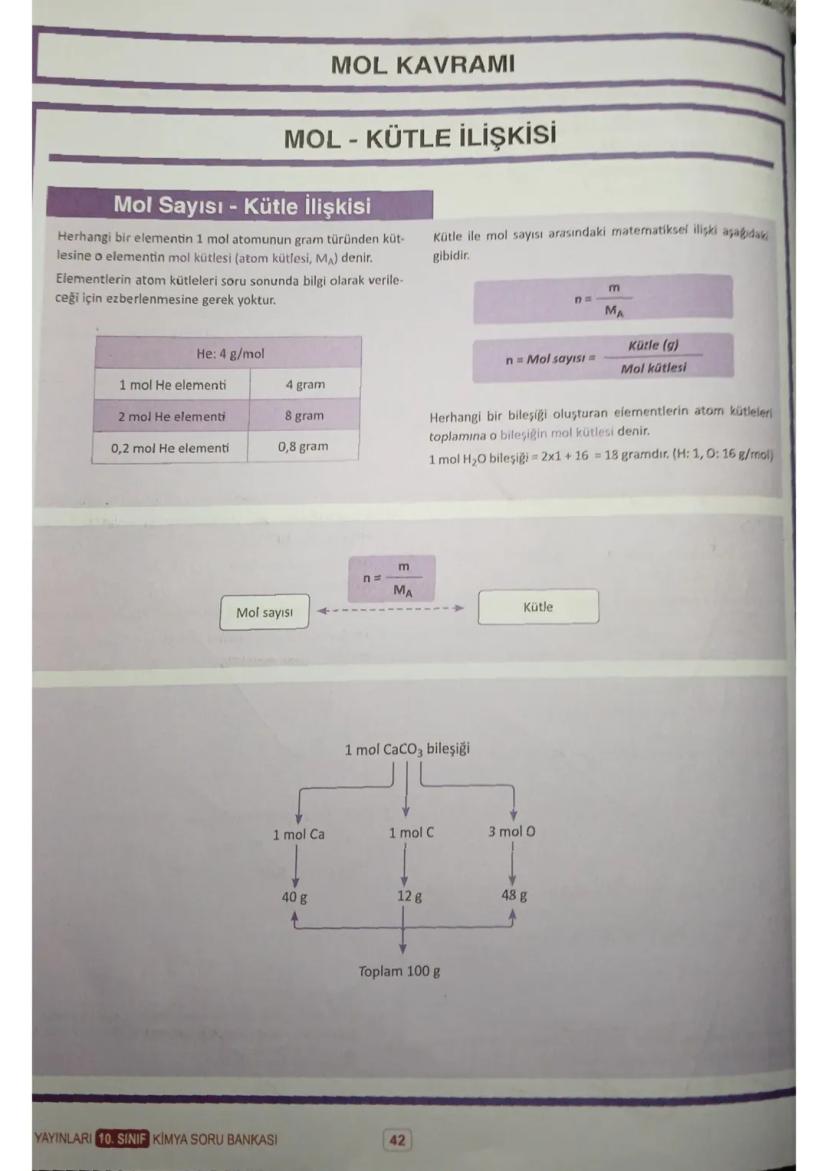
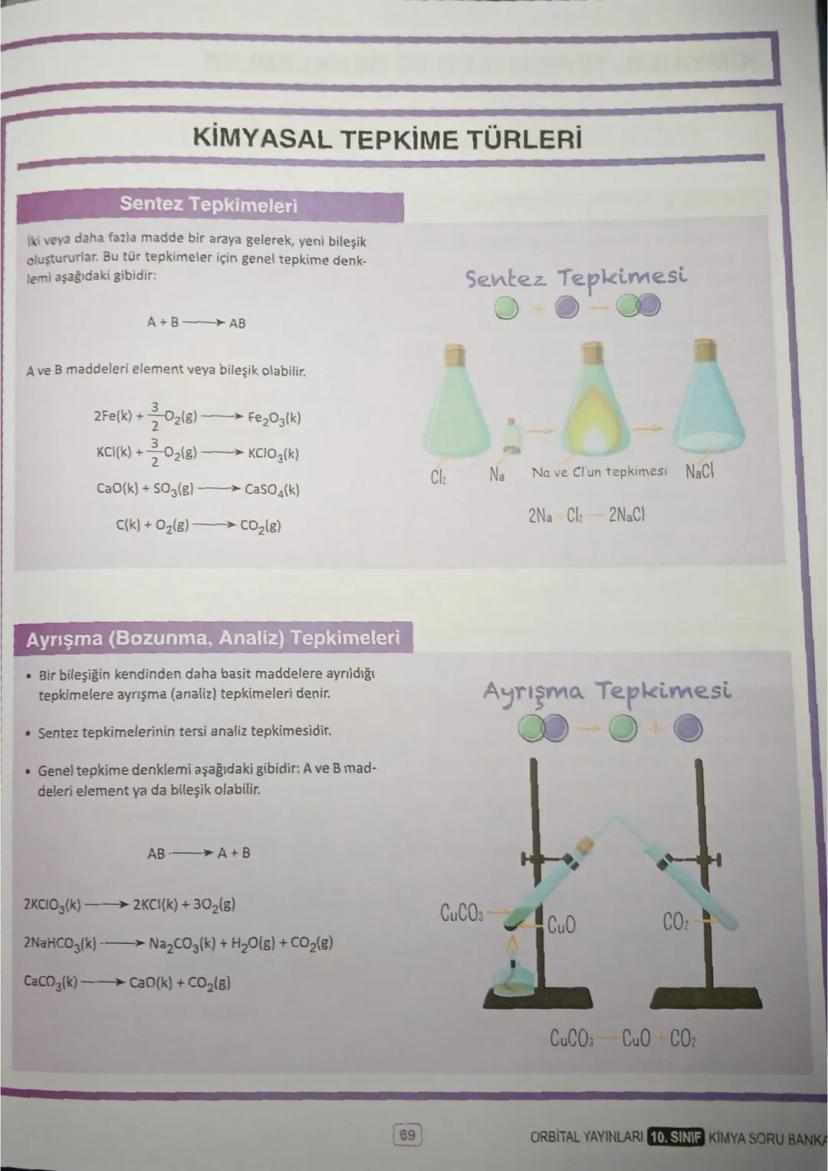
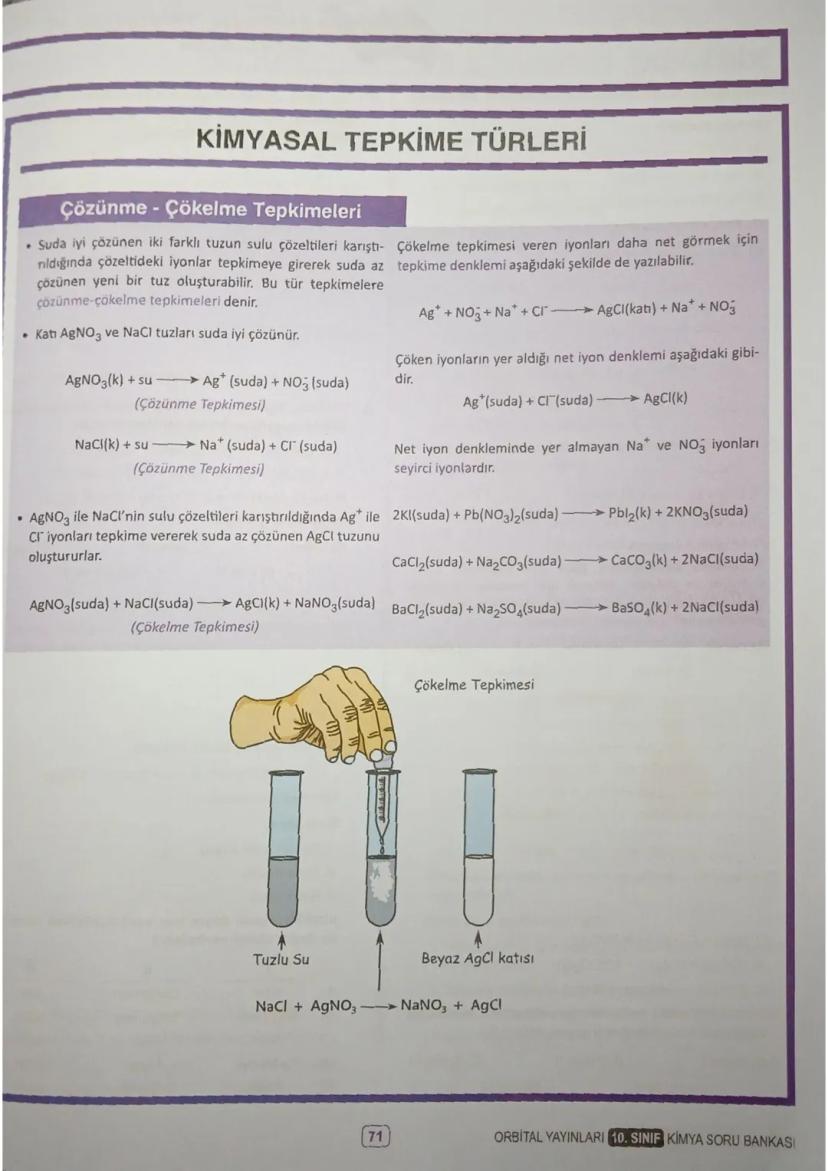
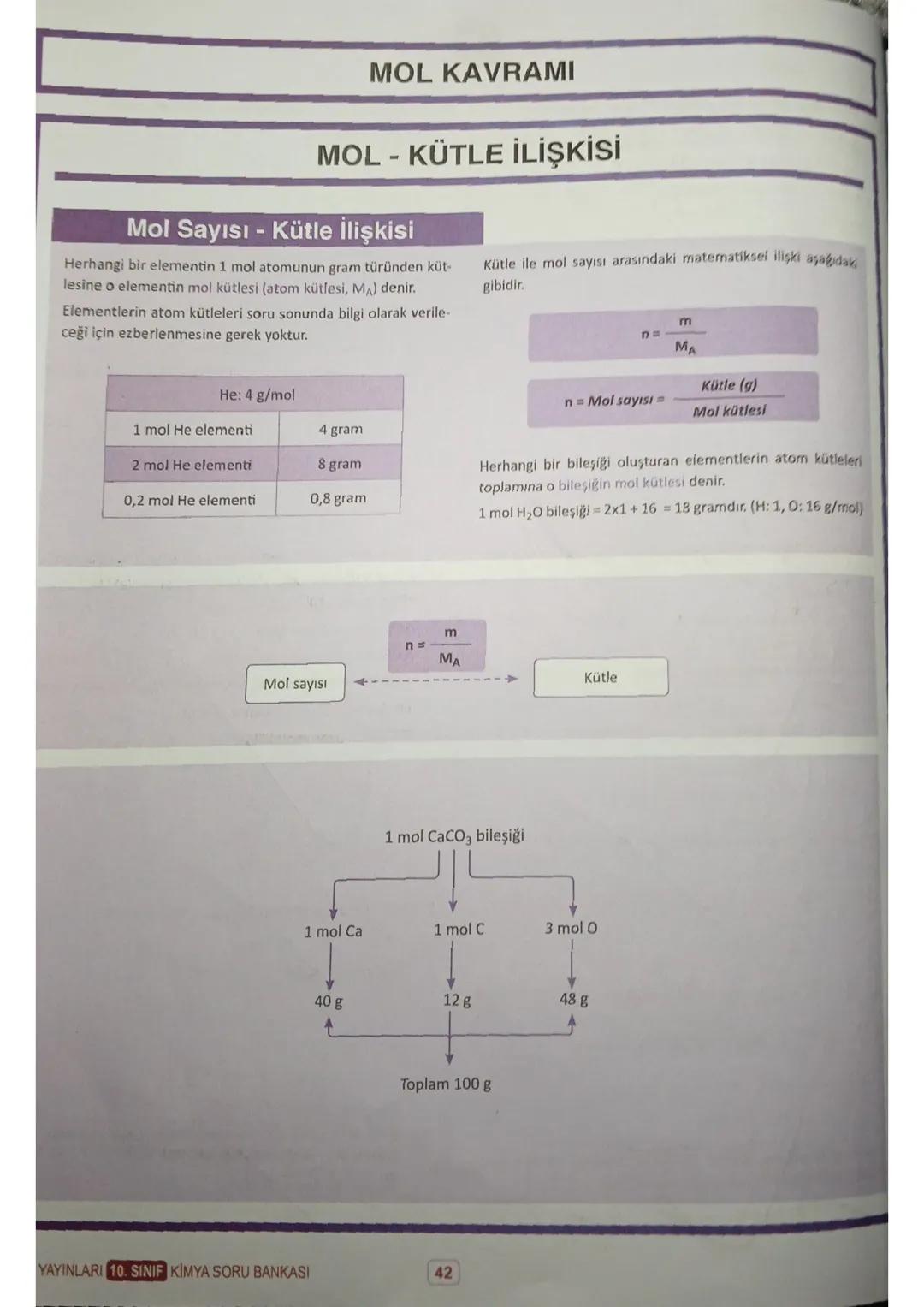
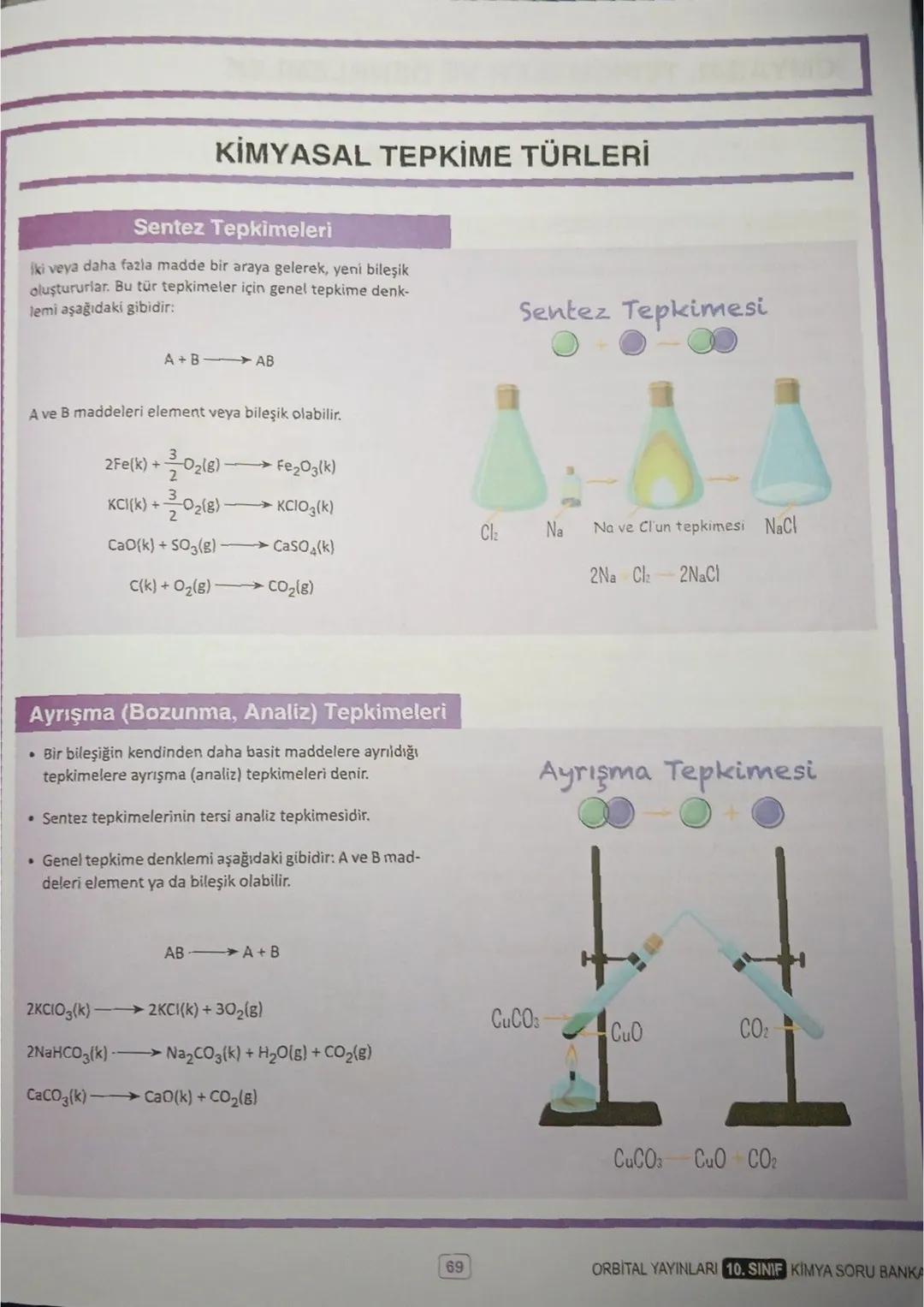
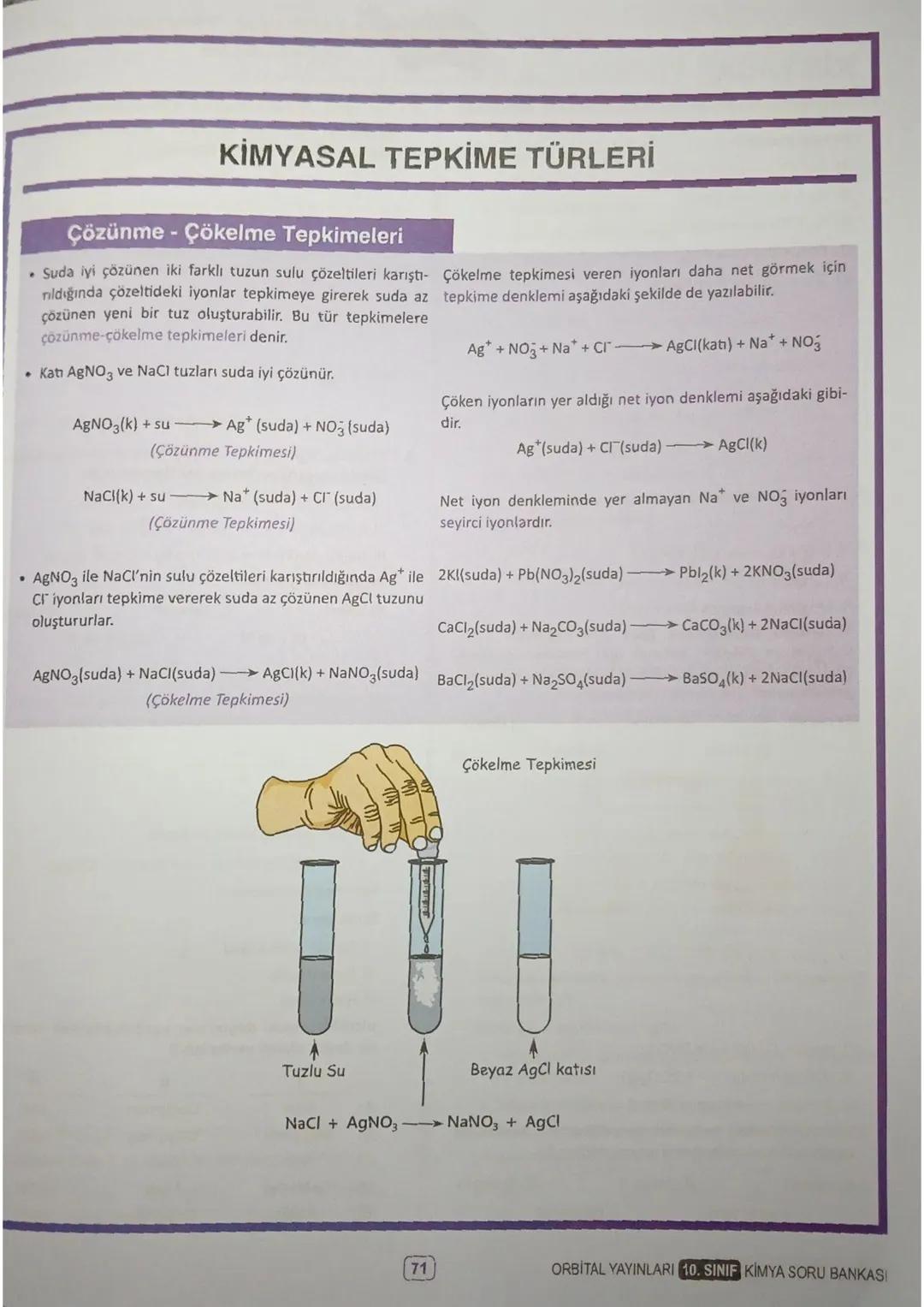
Mol ve Hacim İlişkisi
Normal koşullarda (0°C, 1 atm) 1 mol gaz her zaman 22,4 litre hacim kaplar. Gazın türü önemli değil - ister He, ister CO₂ olsun, 1 mol hepsi 22,4 L yer tutar.
Hacim-mol formülü: n = V/22,4. Bu formülü kullanırken dikkat: sadece normal koşullarda geçerli! Örneğin 0,5 mol CO₂ gazı 11,2 L, 2 mol He gazı 44,8 L hacim kaplar.
Avogadro Yasası da önemli: aynı şartlarda, tanecik sayıları eşit olan gazlar eşit hacim kaplar. Bu yasa, farklı gazların davranışlarını anlamamıza yardımcı olur.
Tüm mol hesaplarını birleştirdiğimizde üçlü bir döngü oluşur: tanecik sayısı ↔ mol sayısı ↔ kütle/hacim. Bu bağlantıları kavrarsan mol konusu artık çok kolay!
Hatırla: Normal koşullarda tüm gazlar için 22,4 L/mol sabit değeridir.