Bileşiklerde Mol ve Atom Hesaplamaları
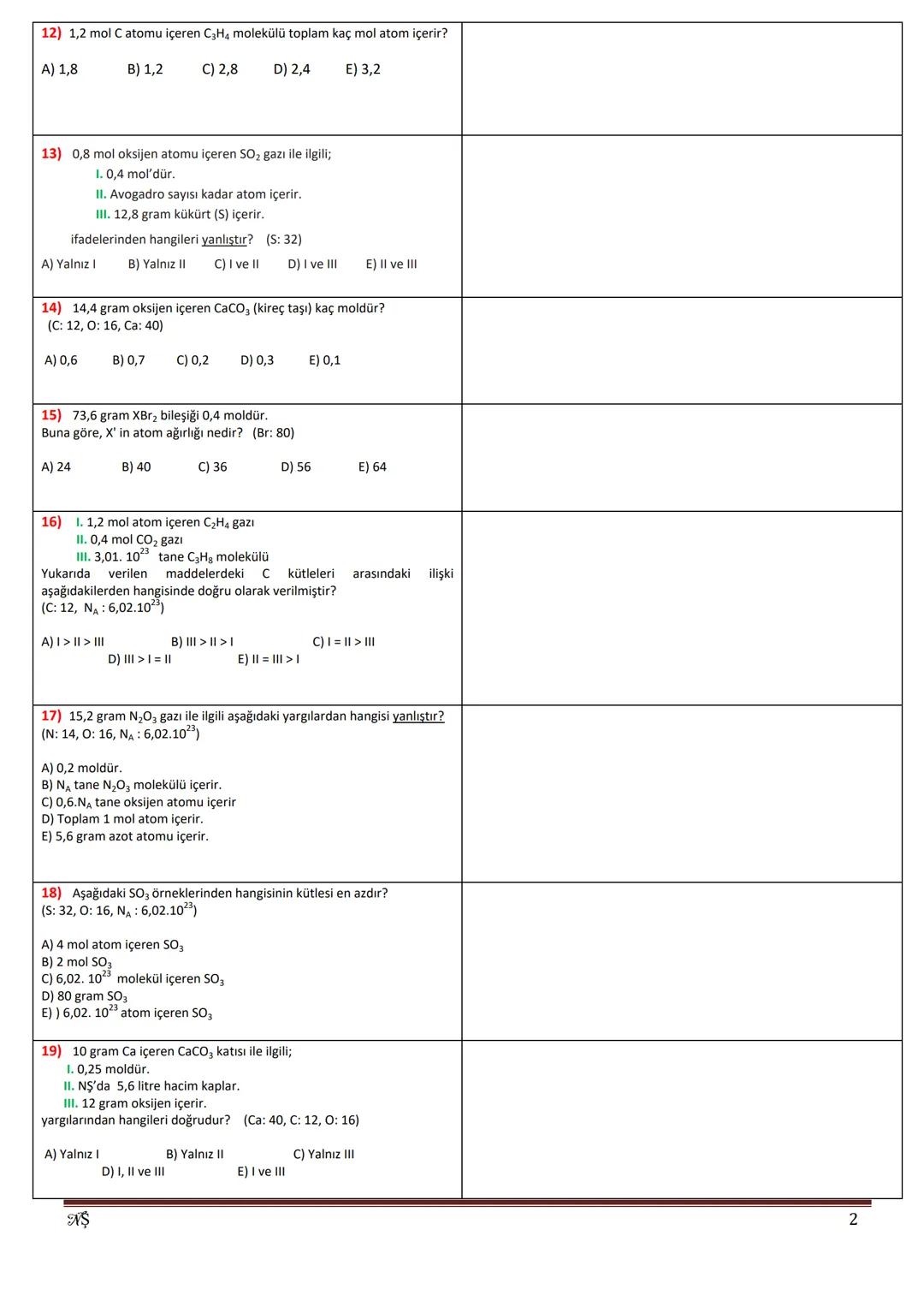
Bir bileşiğin içindeki toplam atom sayısını hesaplarken, bileşikteki her elementin mol sayısını Avogadro sayısıyla çarparız. Örneğin, 1,2 mol C atomu içeren C₃H₄ molekülünde toplam mol atomu: [(1,2 ÷ 3) × 3] + [(1,2 ÷ 3) × 4] = 1,2 + 1,6 = 2,8 mol atom bulunur.
Bir bileşikteki belirli bir atomun mol sayısını bulmak için, o atomun formüldeki katsayısını bileşiğin mol sayısıyla çarparız. Örneğin, 0,4 mol SO₃ gazında oksijen atomlarının mol sayısı: 0,4 × 3 = 1,2 mol olur.
Bir bileşiğin kütlesinden yola çıkarak mol sayısını bulmak için, bileşiğin molekül ağırlığını kullanırız. 73,6 gram XBr₄ bileşiği 0,4 mol olduğuna göre: 73,6 = 0,4 × X+4×80 → X = 24 g/mol bulunur.
İpucu: Maddelerin kütlelerini karşılaştırırken mol sayılarını ve molekül ağırlıklarını dikkate almalısın. Mol sayısı aynıysa, molekül ağırlığı büyük olan maddenin kütlesi daha büyük olur!
Bir bileşik içindeki elementlerin yüzde miktarlarını hesaplarken, o elementin kütlesini toplam bileşik kütlesine böleriz. Örneğin, 0,25 mol CaCO₃ katısında 10 gram Ca bulunur ve bu bileşik: 0,25 × [(40) + (12) + (3×16)] = 25 gram gelir.