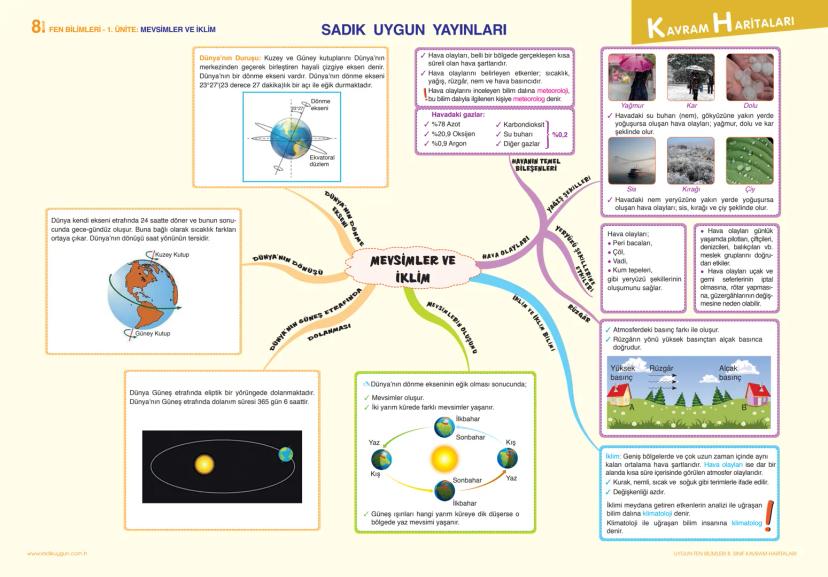
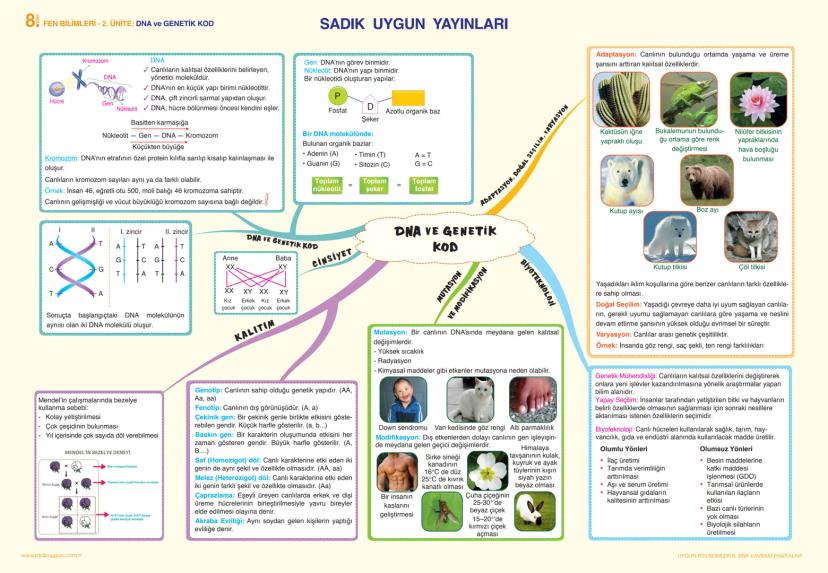
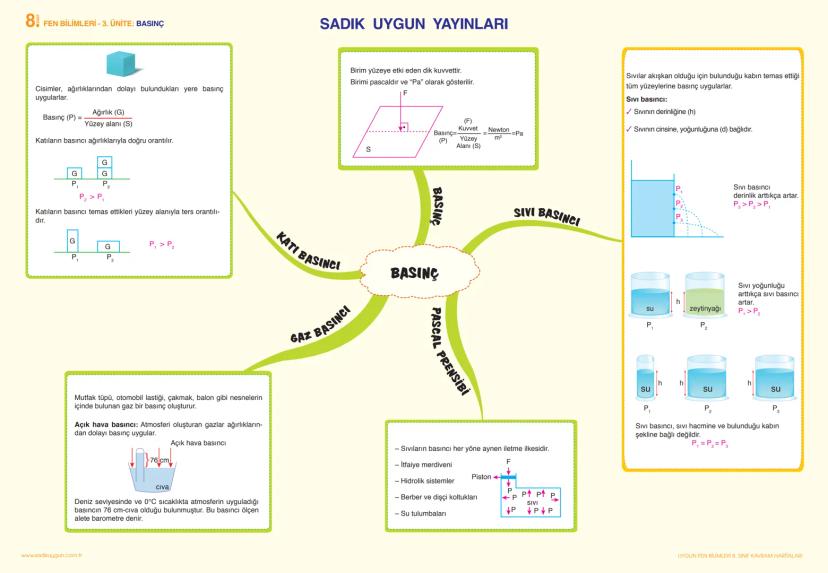
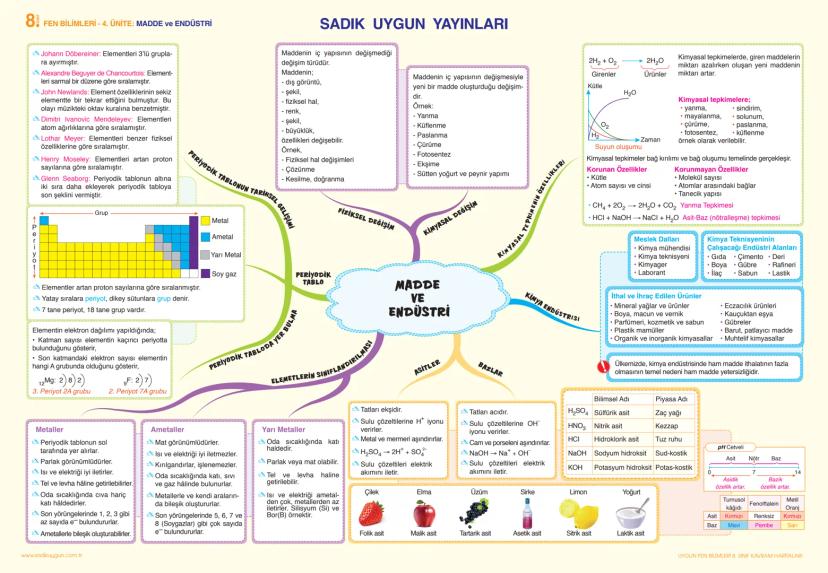
Madde ve Endüstri
Fiziksel değişim, maddenin iç yapısının değişmediği bir değişimdir. Maddenin dış görüntü, şekil, fiziksel hal, renk gibi özellikleri değişebilir. Fiziksel değişimde maddenin kütlesi, molekül sayısı, atom sayısı ve cinsi gibi özellikleri korunur.
Kimyasal değişim ise maddenin iç yapısının değişmesiyle yeni bir madde oluşturmasıdır. Örneğin yanma, sindirim, solunum, mayalanma, çürüme, paslanma, fotosentez kimyasal değişimlerdir. Kimyasal tepkimelerde giren maddelerin miktarı azalırken oluşan yeni maddenin miktarı artar.
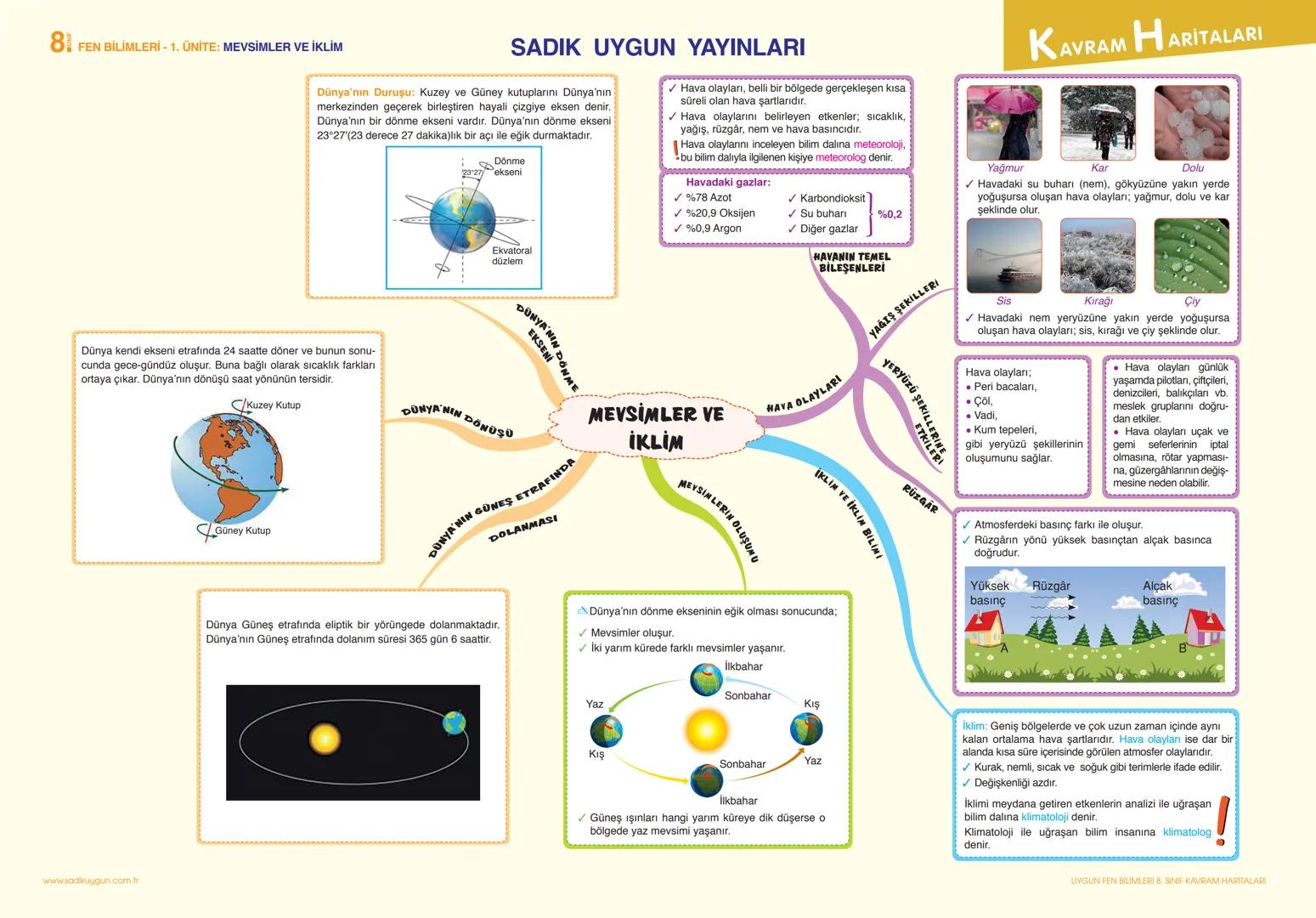
Periyodik tablo, elementlerin artan proton sayılarına göre sıralandığı tablodur. Yatay sıralara periyot, dikey sütunlara grup denir. 7 tane periyot, 18 tane grup vardır. Elementin elektron dağılımına bakıldığında, katman sayısı elementin hangi periyotta olduğunu, son katmandaki elektron sayısı elementin hangi A grubunda olduğunu gösterir.
İlginç Bilgi: Periyodik tablonun tarihsel gelişiminde birçok bilim insanı katkı sağlamıştır: Döbereiner, Chancourtois, Newlands, Mendeleyev, Meyer, Moseley ve Seaborg.
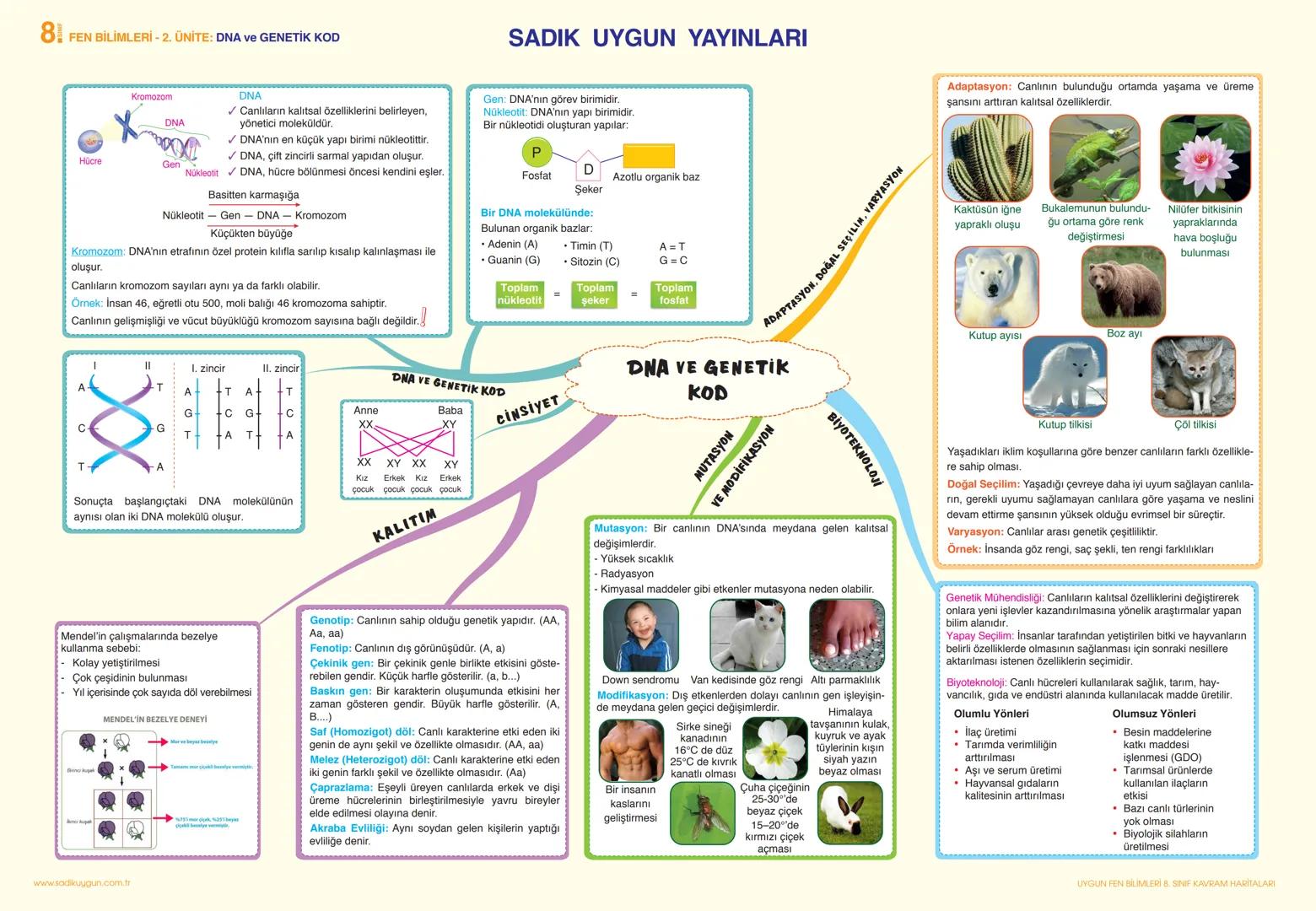
Elementler, metaller, ametaller ve yarı metaller olarak sınıflandırılır. Metaller parlak görünümlü, ısı ve elektriği iyi ileten, tel ve levha haline getirilebilen, oda sıcaklığında cıva hariç katı halde bulunan elementlerdir. Ametaller ise mat görünümlü, ısı ve elektriği iyi iletmeyen, kırılgan ve işlenemeyen elementlerdir.
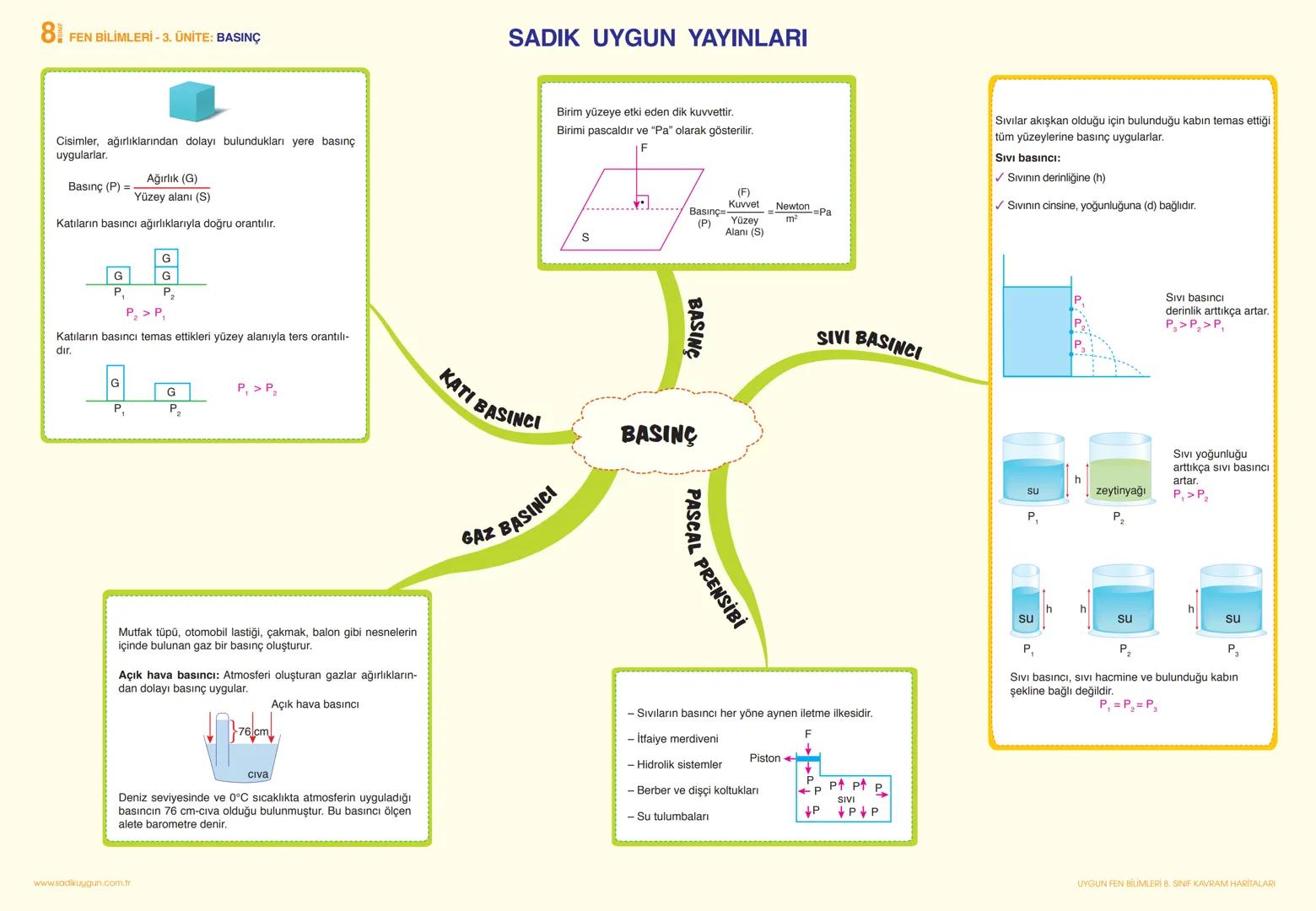
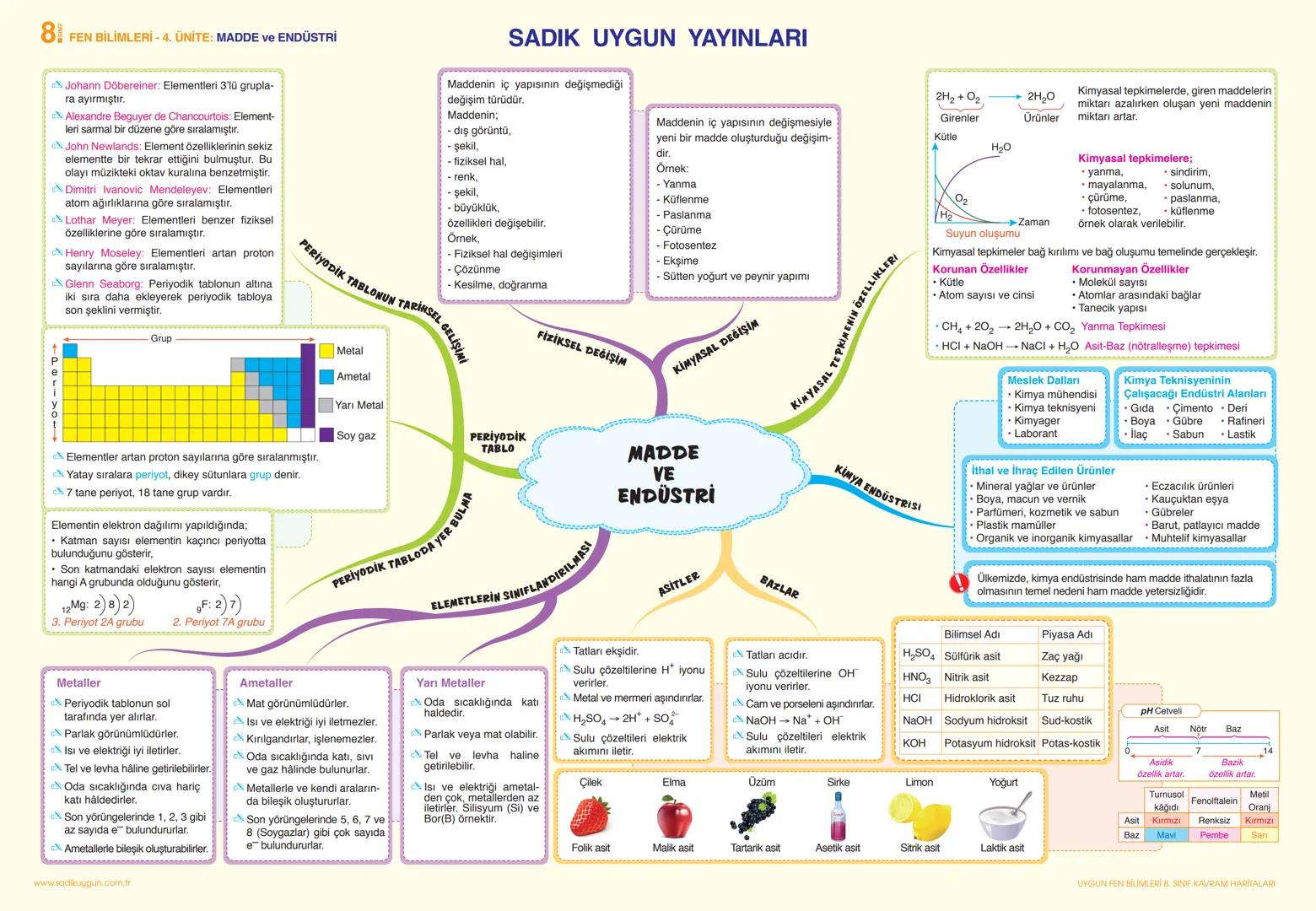
Asitler ekşi tatlı, bazlar acı tatlıdır. Asitler sulu çözeltilere H+ iyonu, bazlar ise OH- iyonu verirler. Asitlik-bazlık derecesi pH cetveliyle belirlenir. pH değeri 0-7 arası asidik, 7-14 arası bazik, 7 ise nötr özellik gösterir.