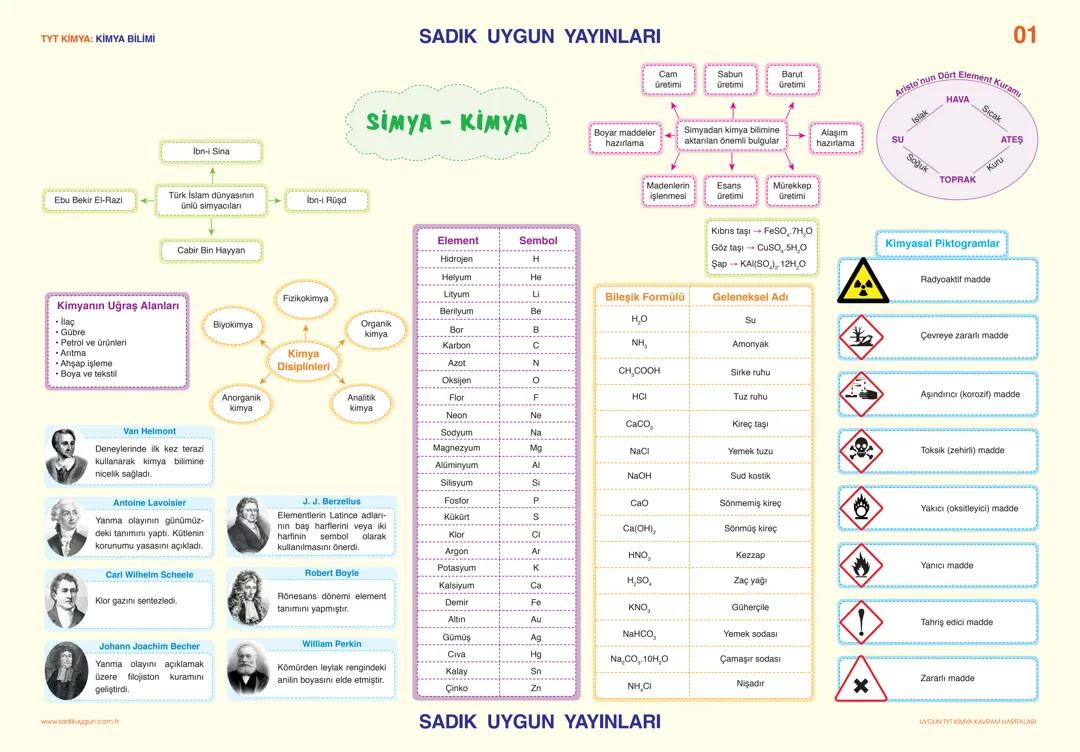
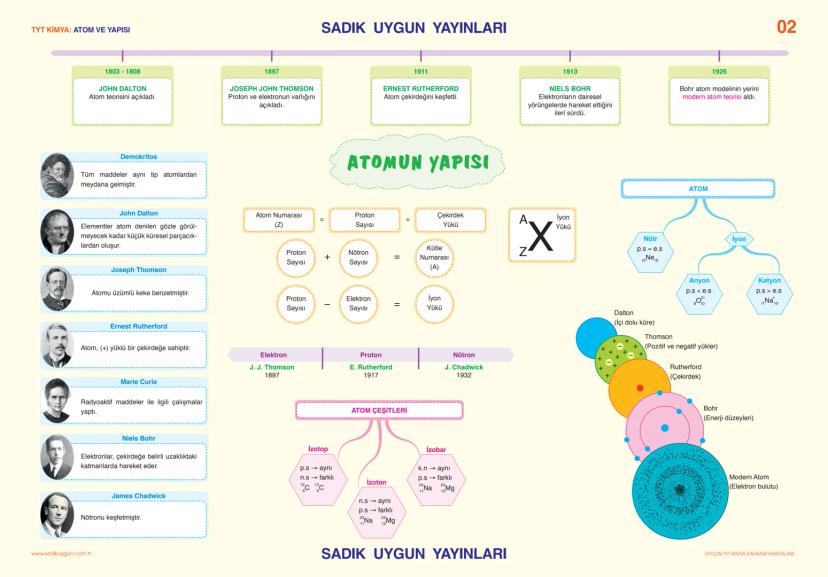
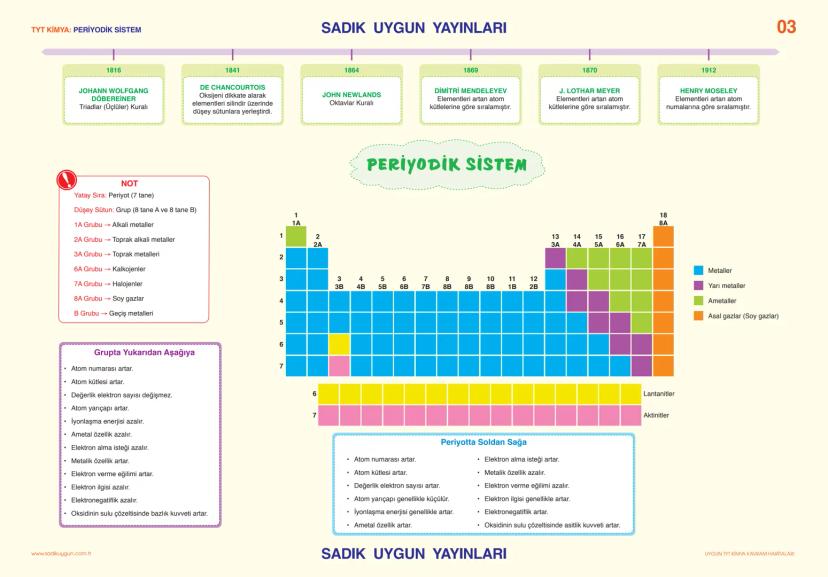
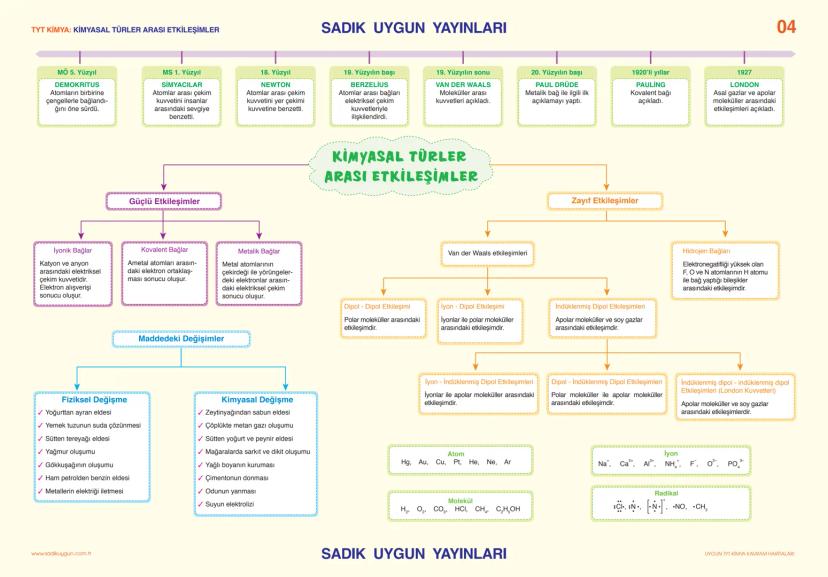
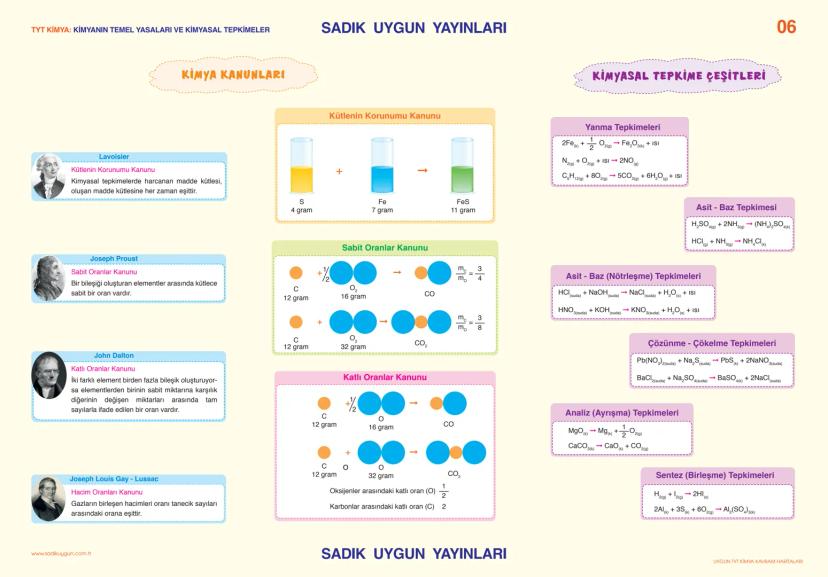
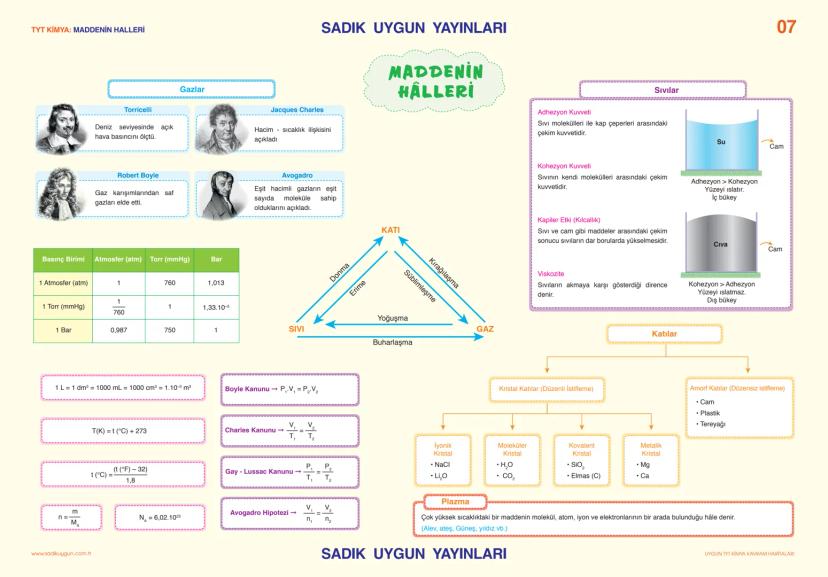
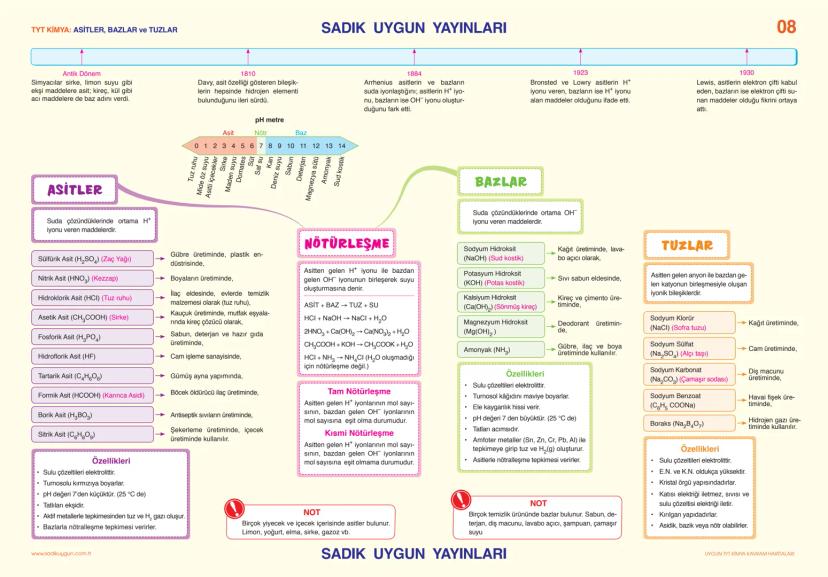
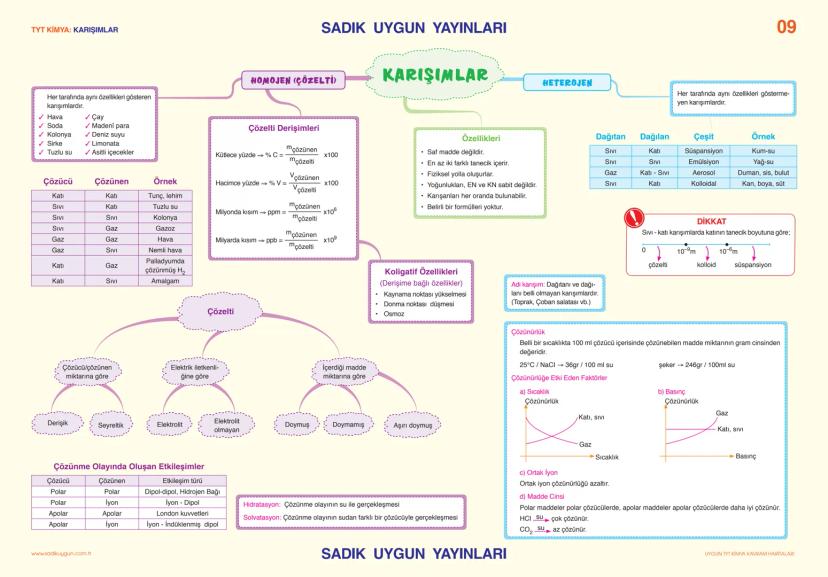
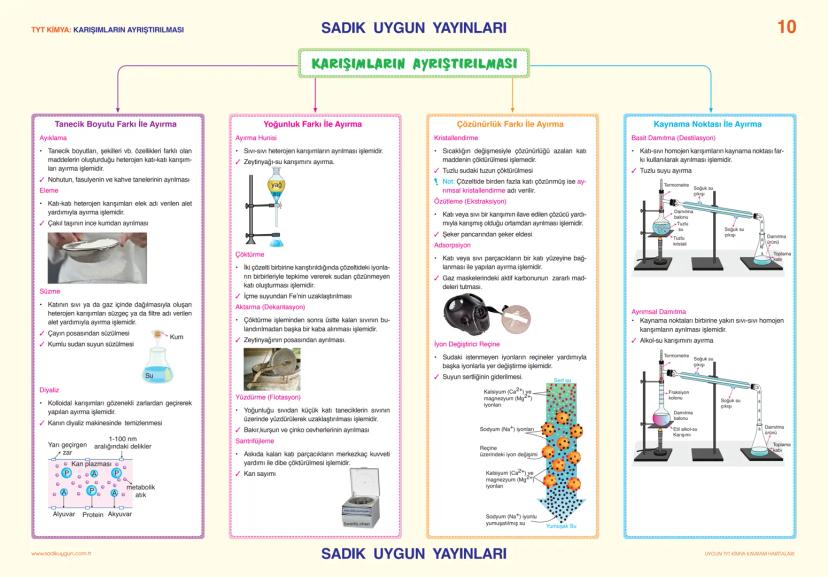
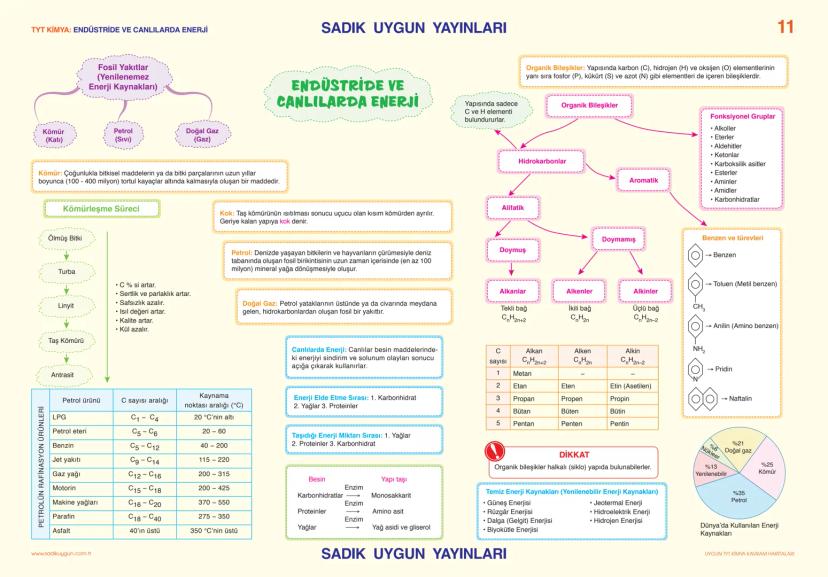
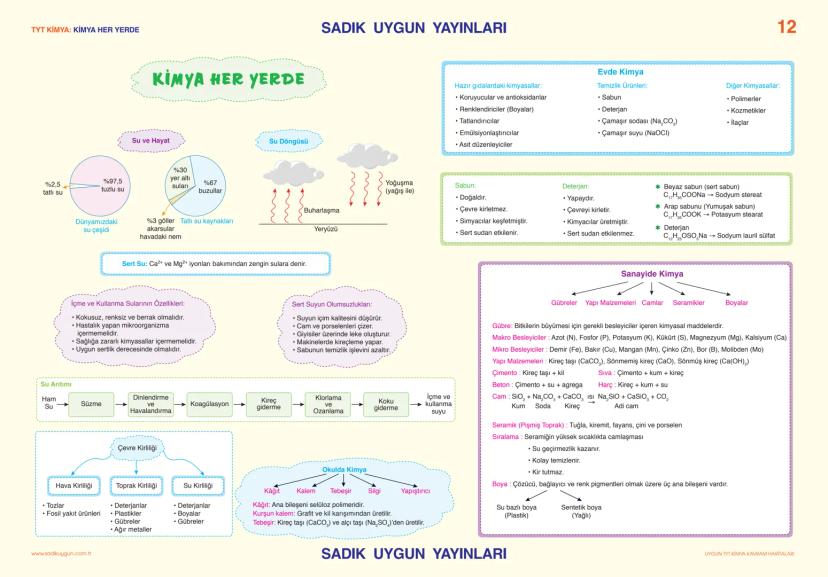
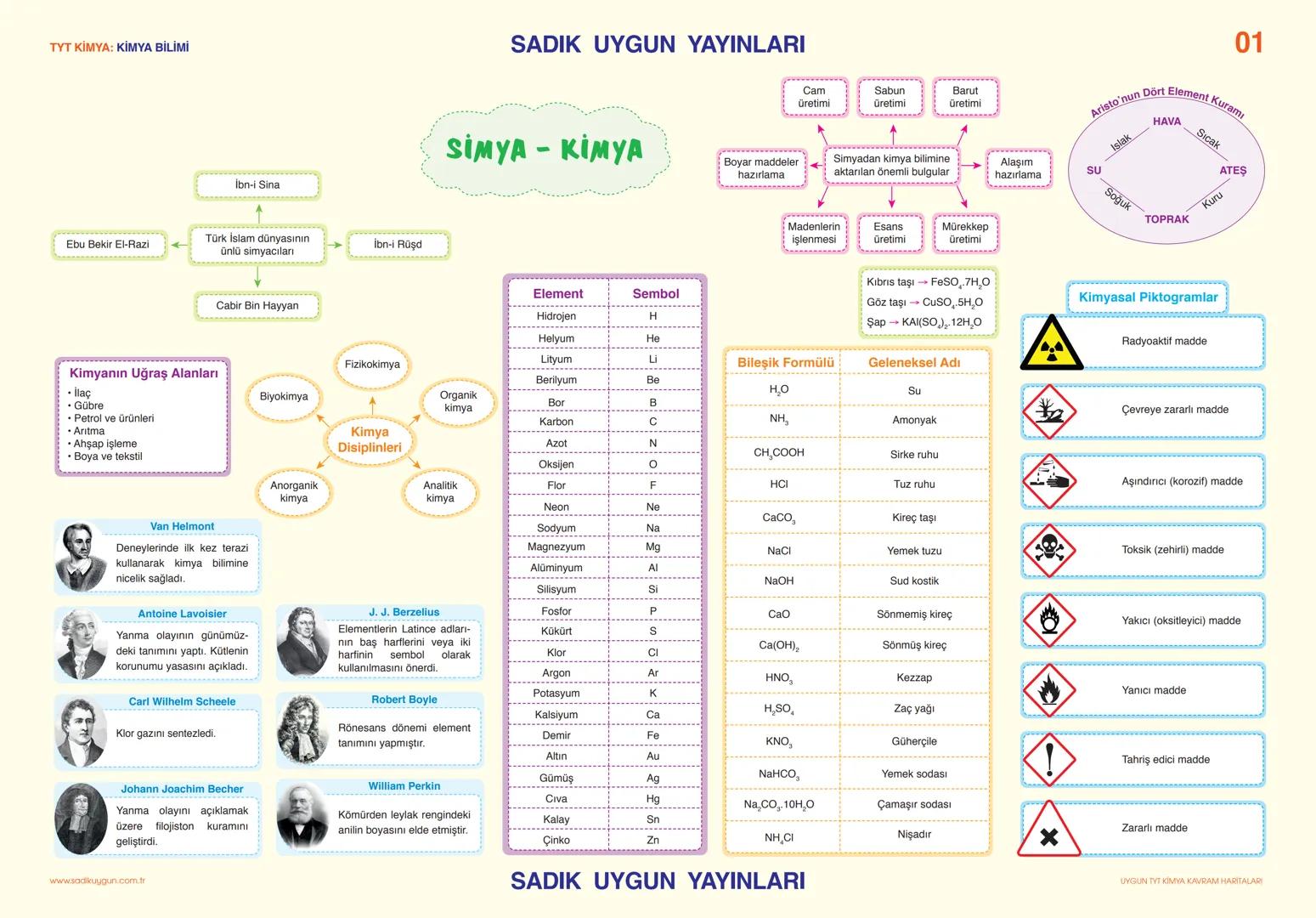
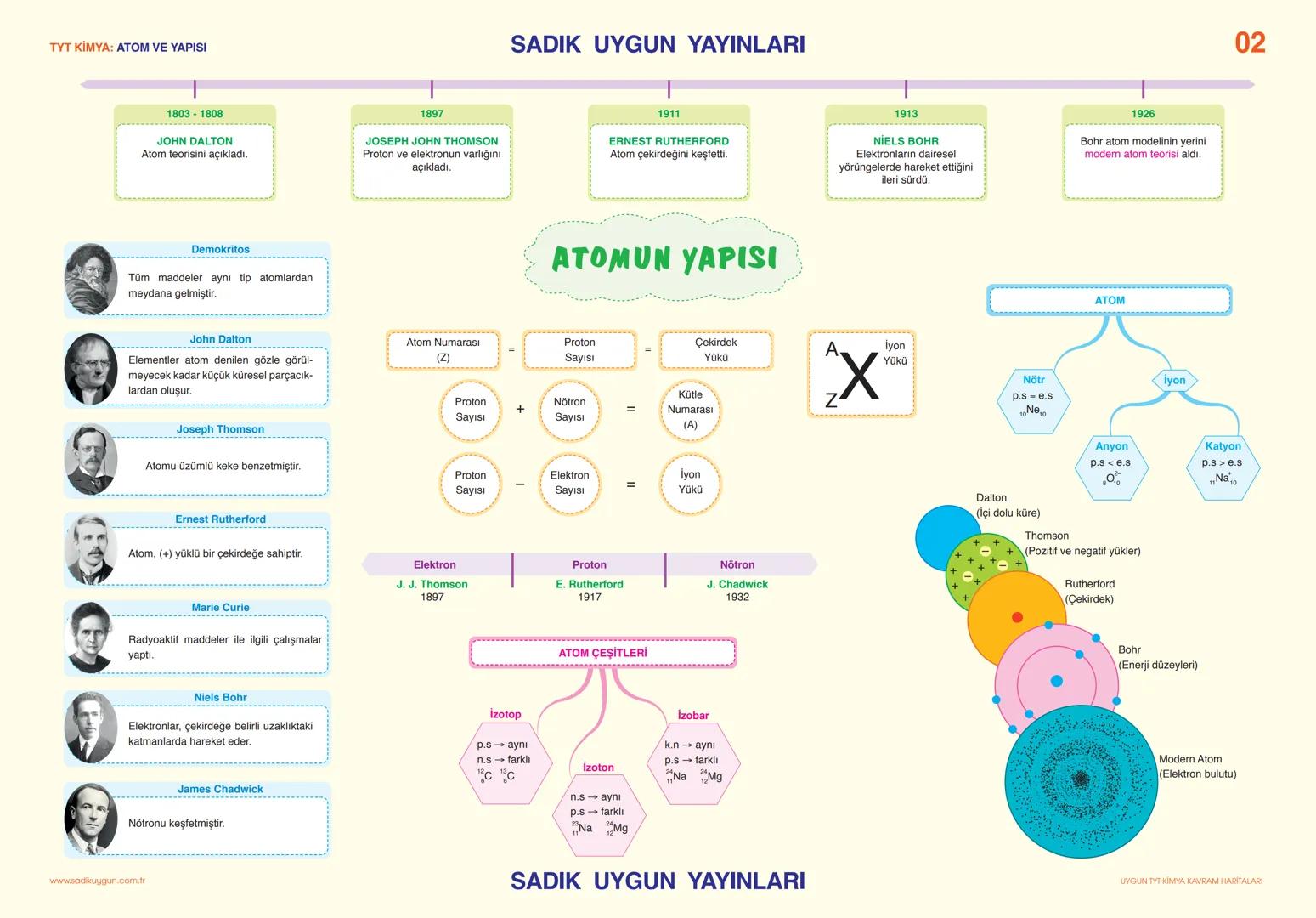
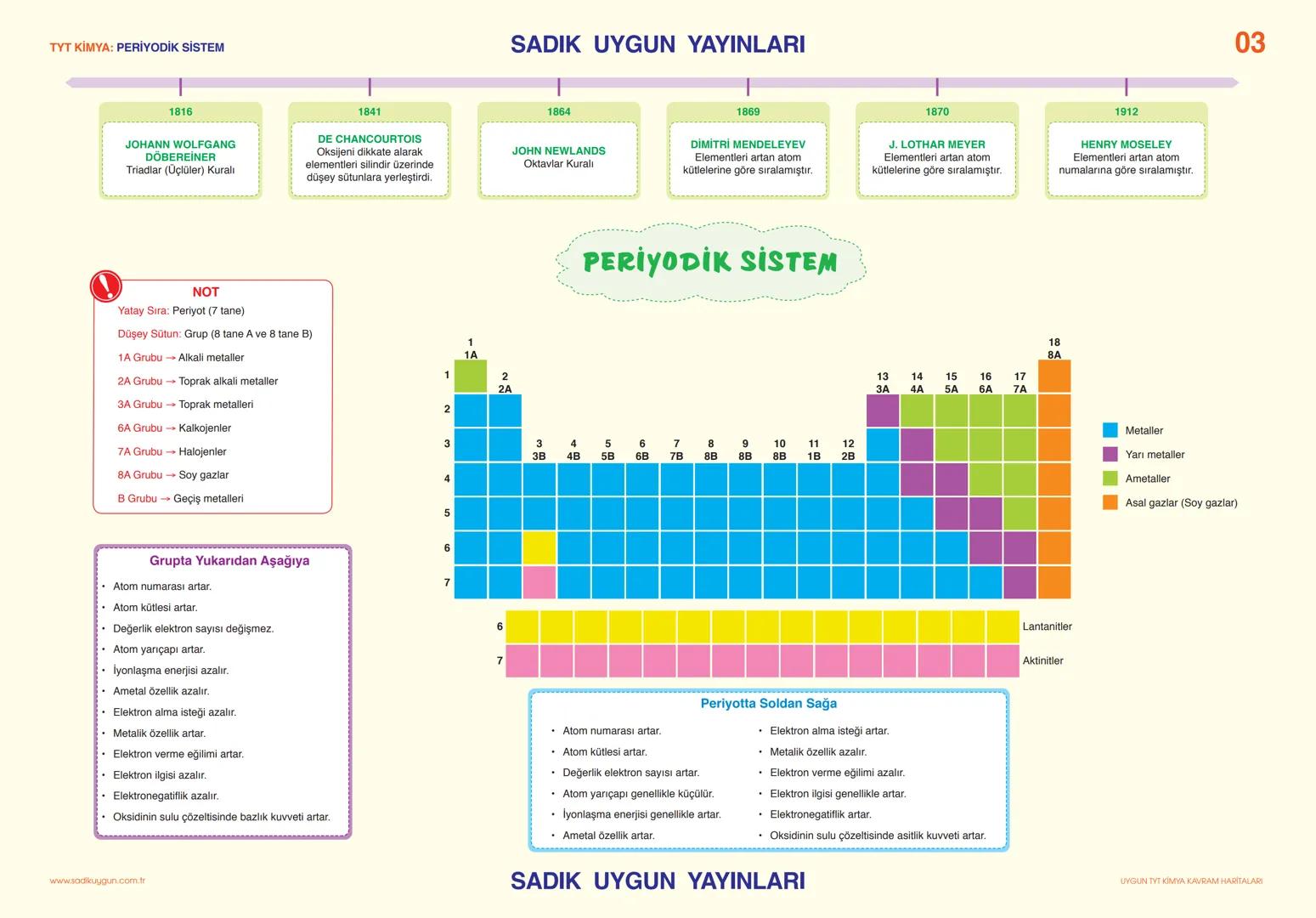
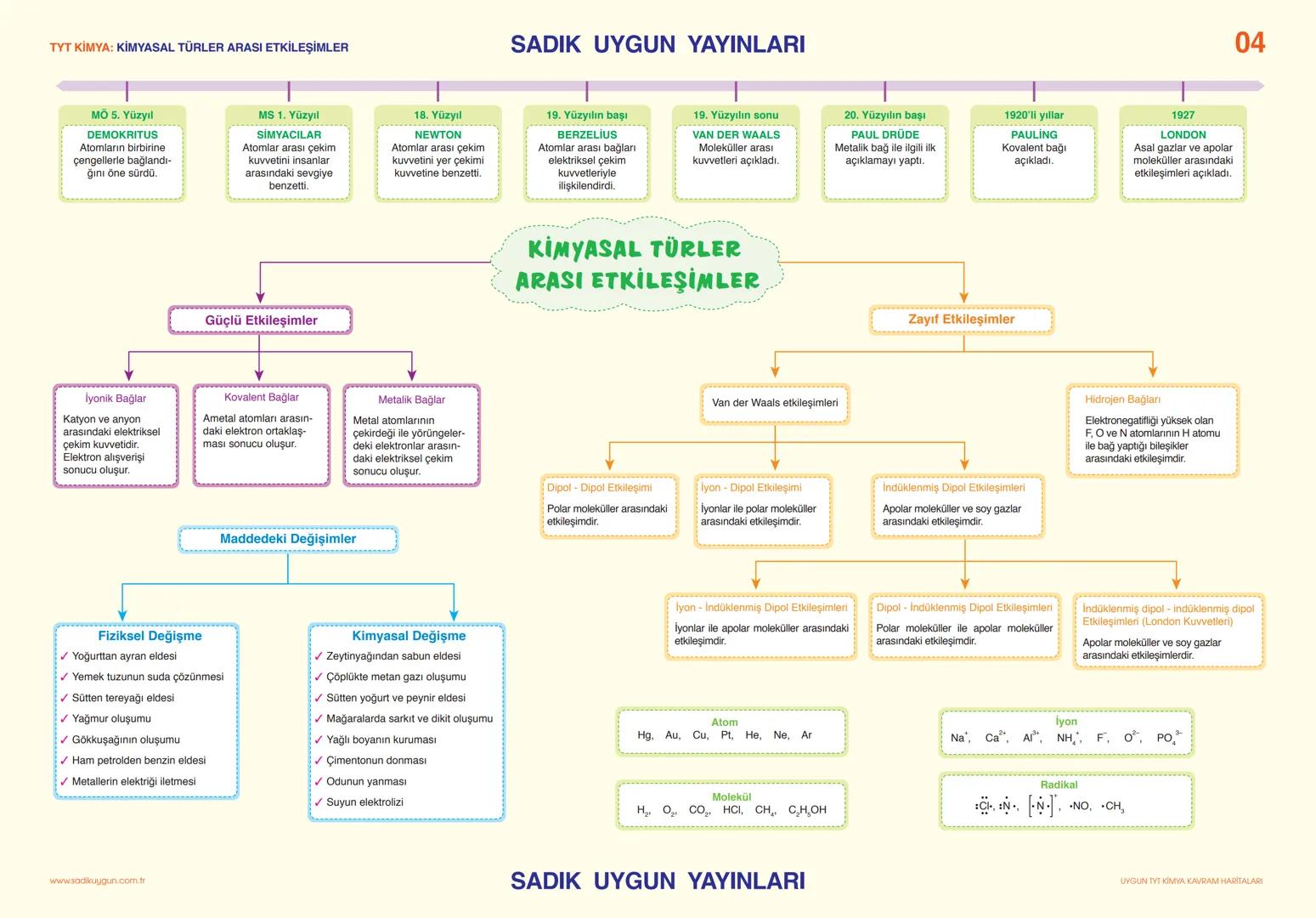
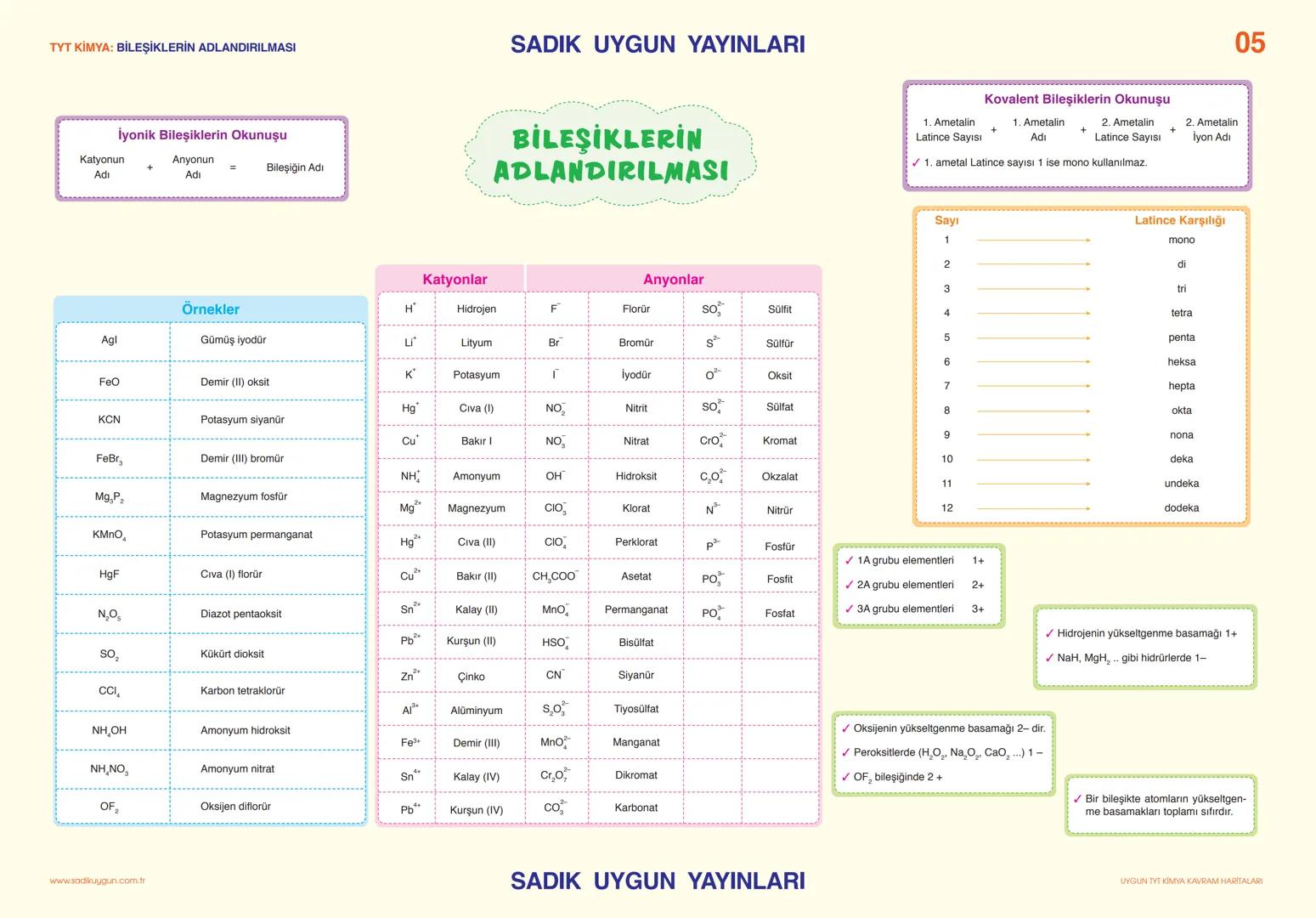
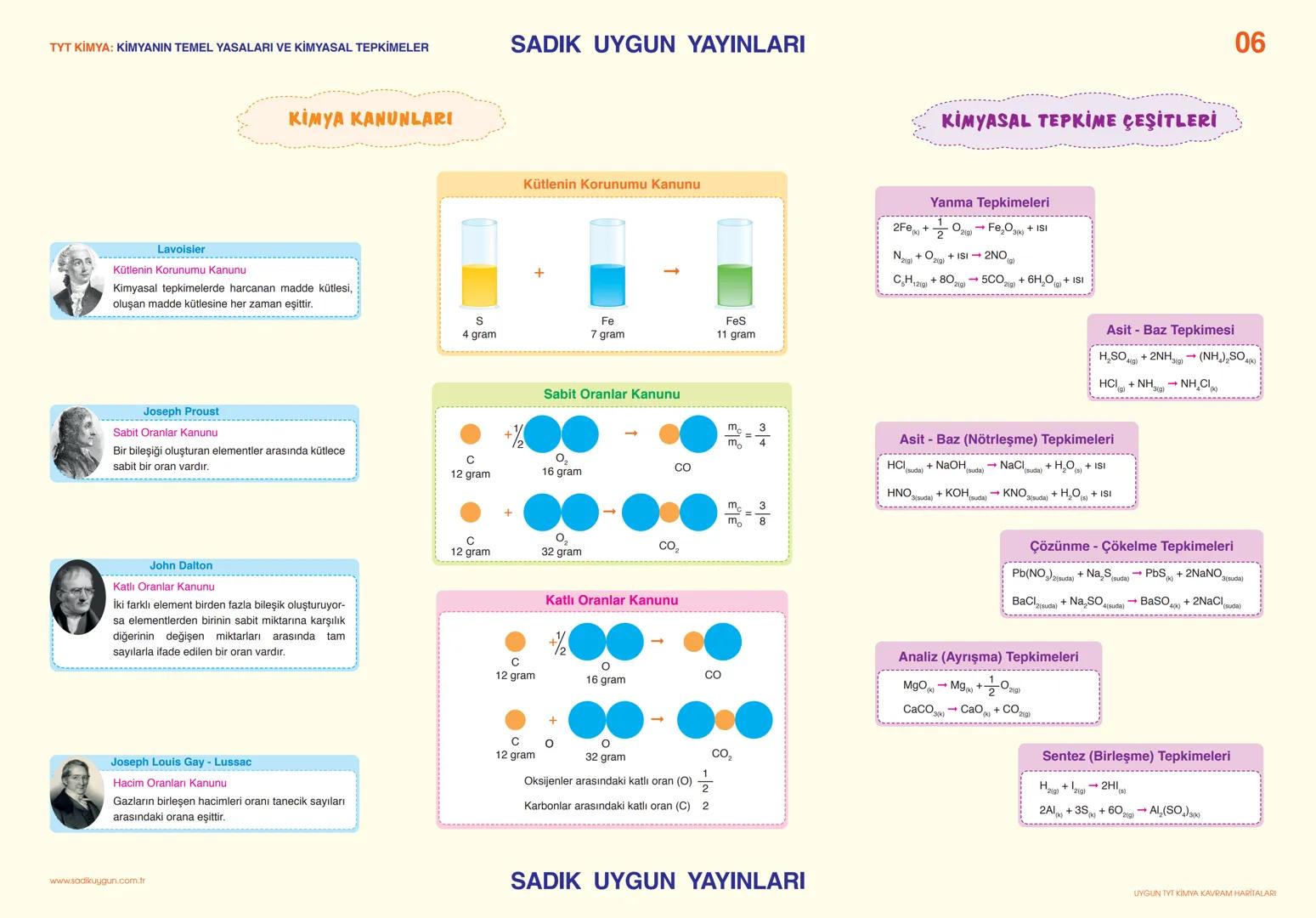
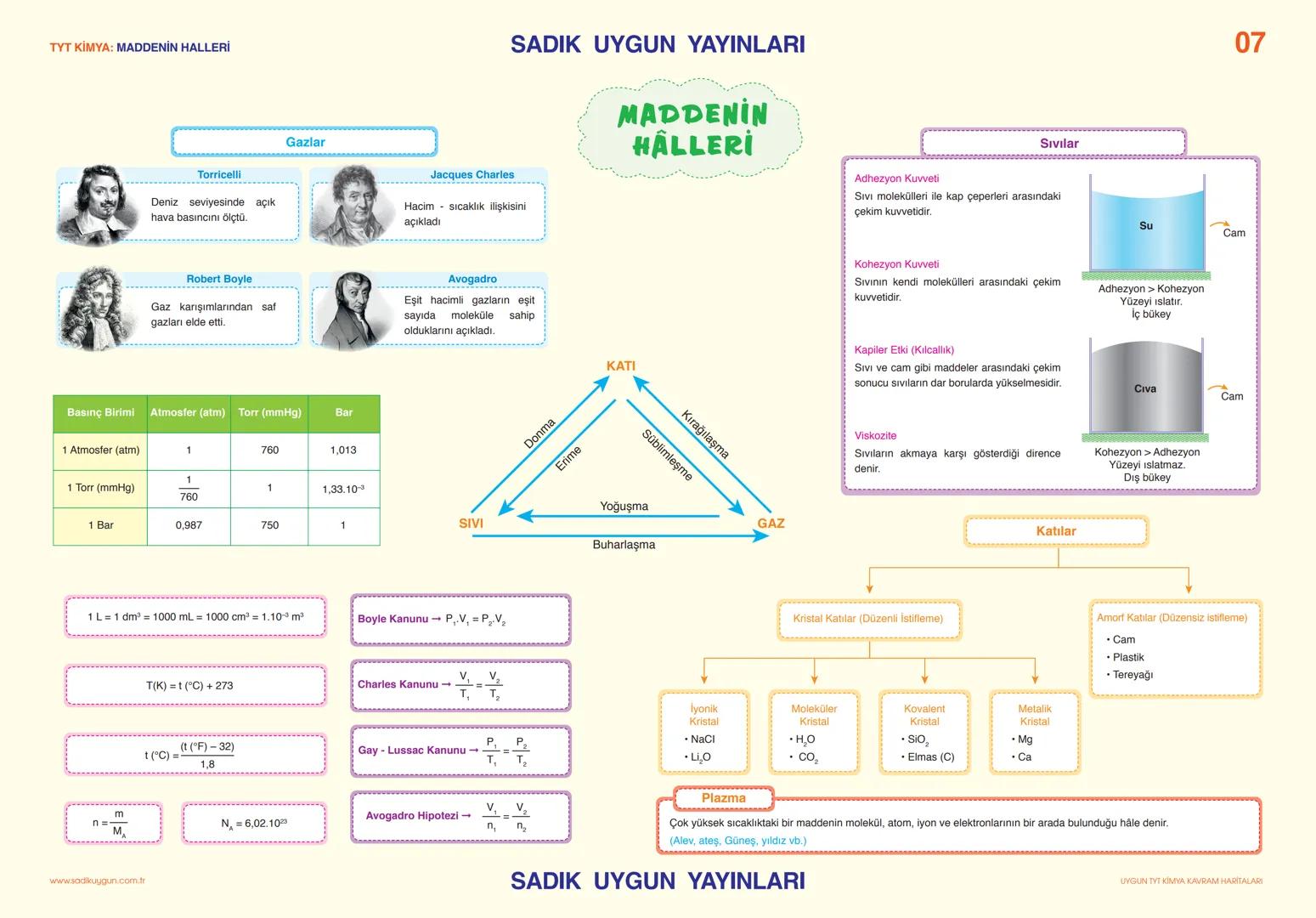
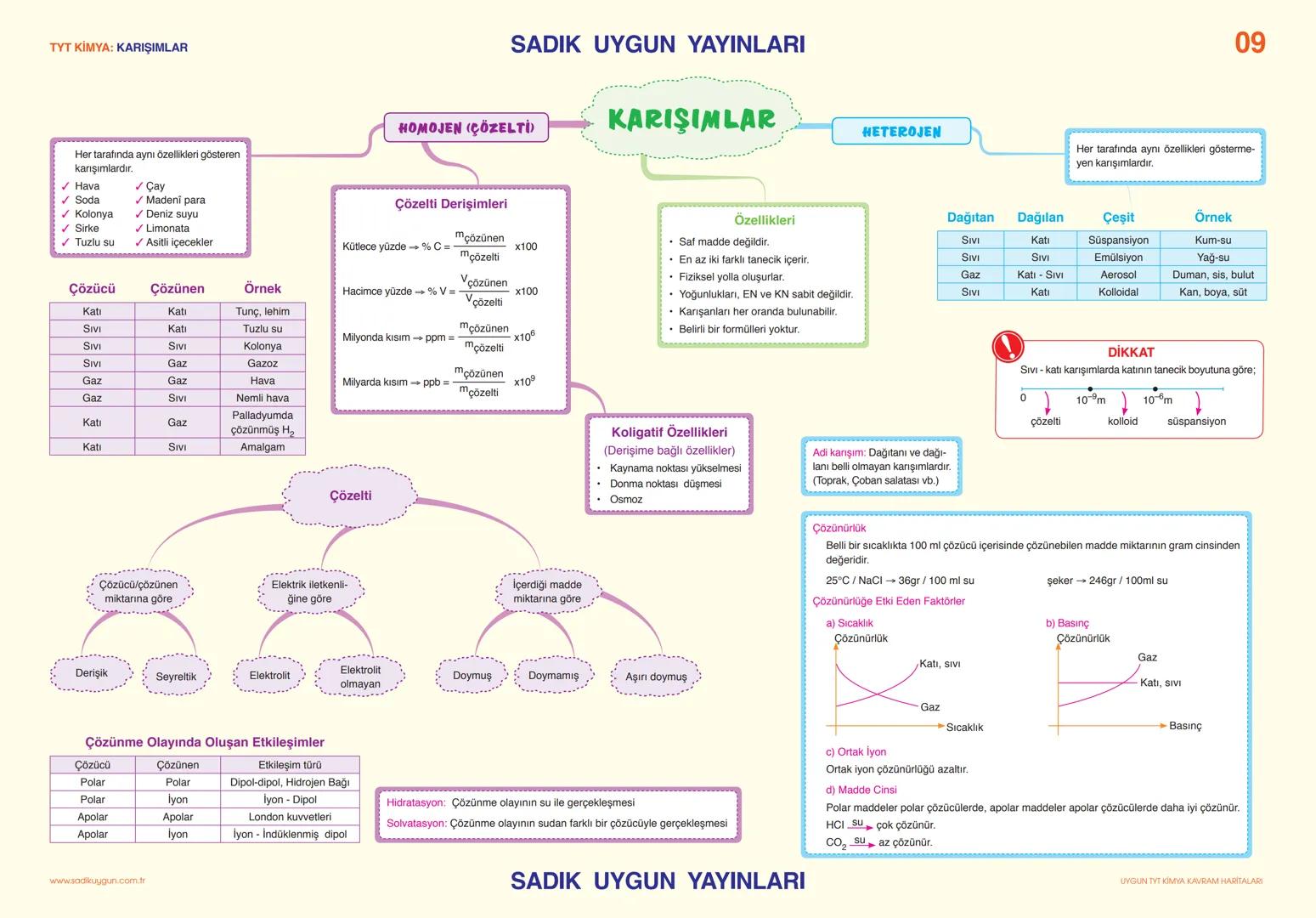
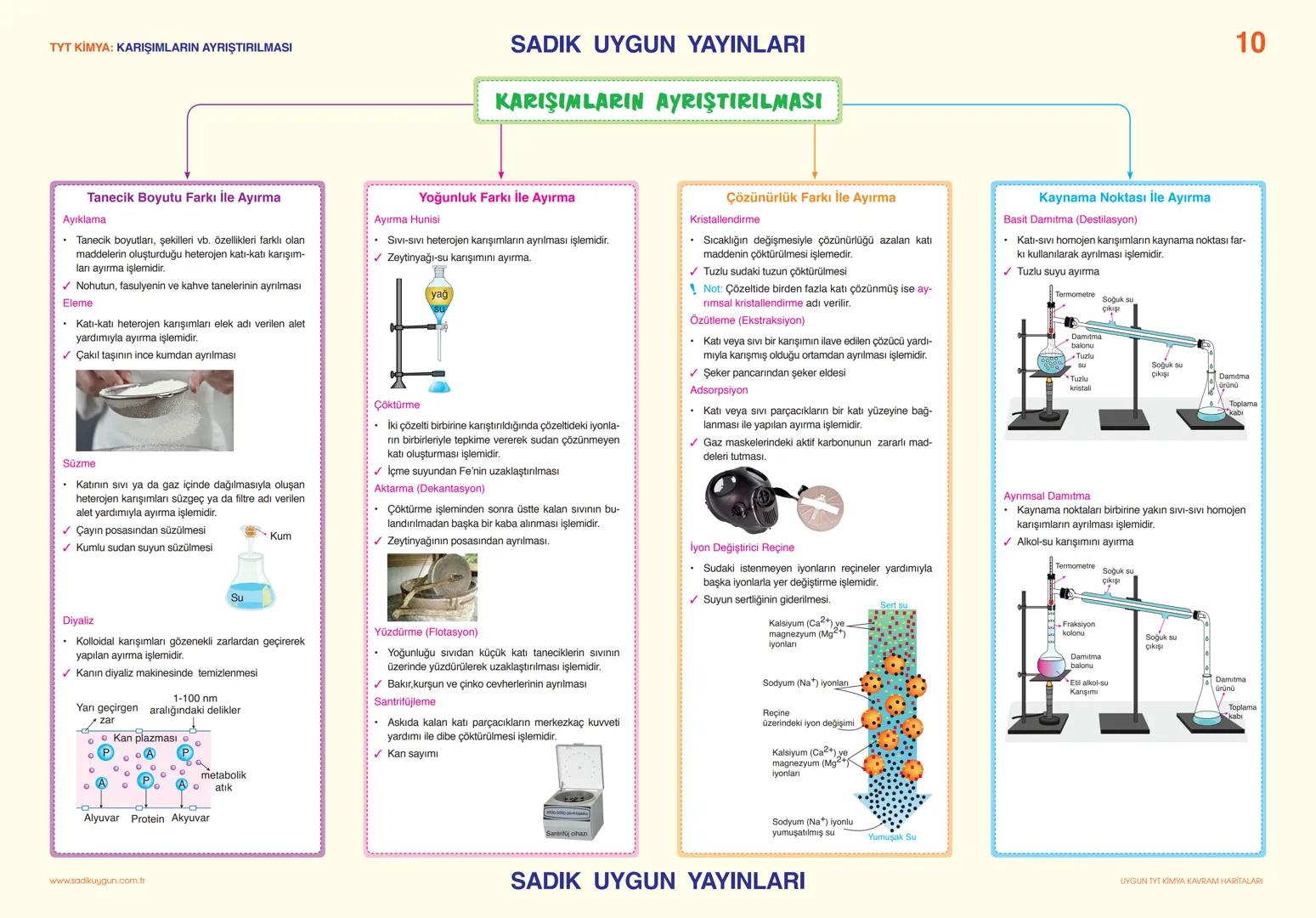
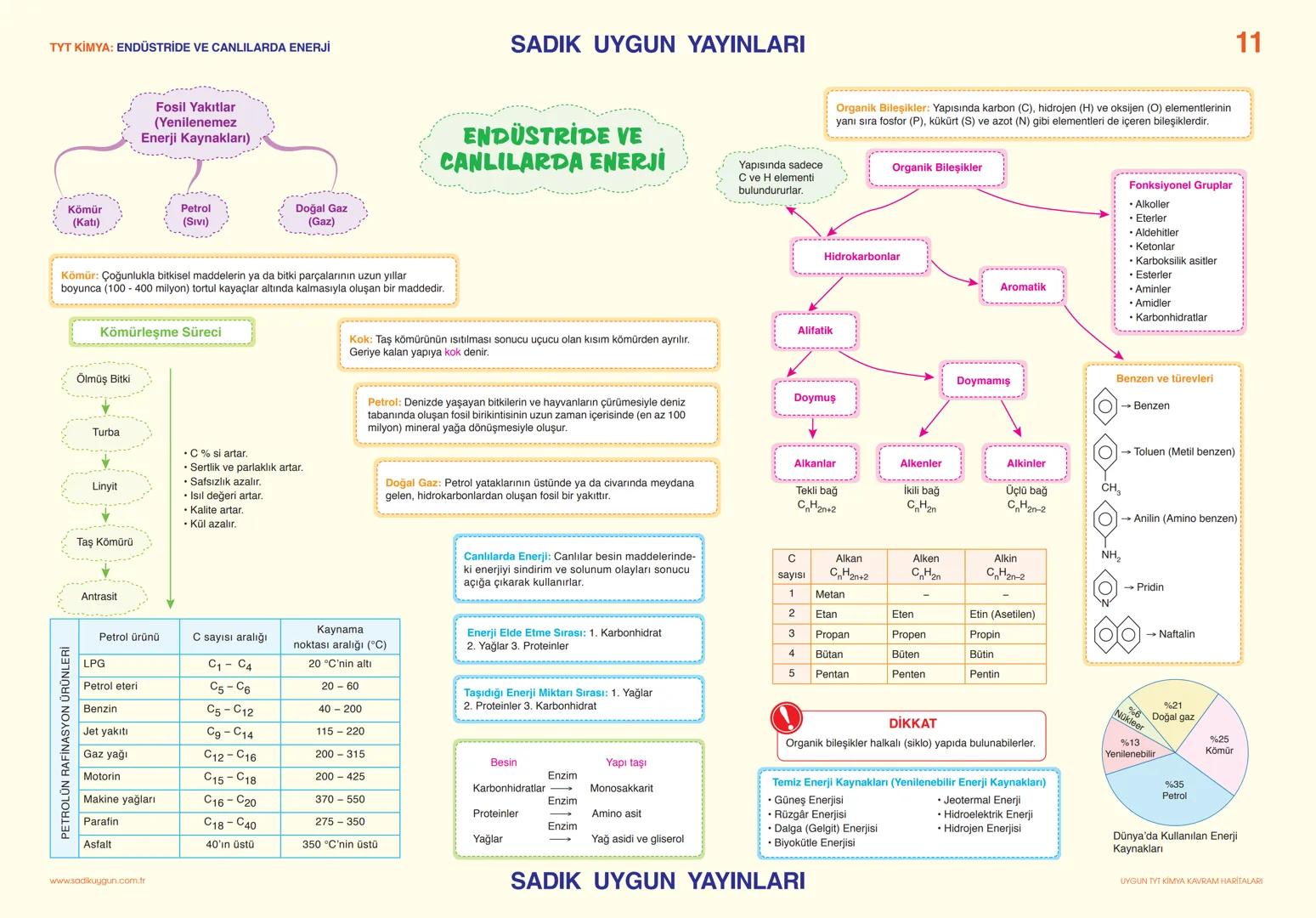
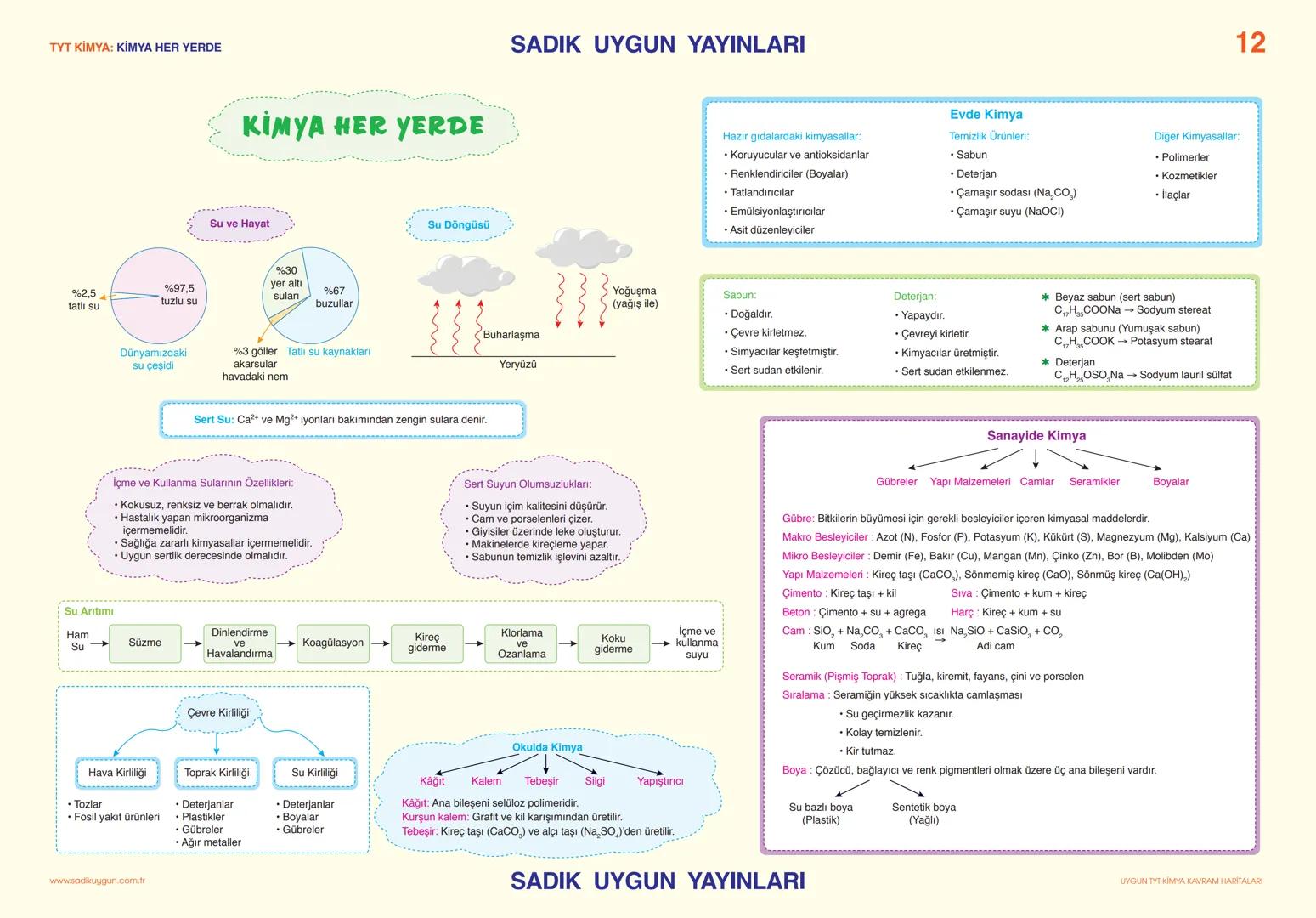
Asitler, Bazlar ve Tuzlar
Asitler ve bazlar hayatımızın her yerinde! Limon, sirke, gazlı içecekler asidik; sabun, deterjan, diş macunu ise bazik özellik gösterir.
Asitler, suda çözündüklerinde ortama H⁺ iyonu veren maddelerdir. Sülfürik asit (H₂SO₄), nitrik asit (HNO₃), hidroklorik asit (HCl) en bilinen asitlerdir. Asitlerin özellikleri arasında ekşi tat, turnusol kâğıdını kırmızıya boyama, metalleri aşındırma ve pH değerinin 7'den küçük olması sayılabilir.
Bazlar ise suda çözündüklerinde ortama OH⁻ iyonu veren maddelerdir. Sodyum hidroksit (NaOH), potasyum hidroksit (KOH), kalsiyum hidroksit Ca(OH)2 yaygın bazlardır. Bazlar acımsı tada sahiptir, ele kayganlık hissi verir, turnusol kâğıdını maviye boyar ve pH değerleri 7'den büyüktür.
Dikkat: Kuvvetli asit ve bazlarla doğrudan temas etmek tehlikelidir! Laboratuvarda ve evde kullanırken her zaman güvenlik önlemleri almalısın.
pH ölçeği, bir çözeltinin asitlik veya bazlık derecesini gösterir. pH 0-7 arası asidik, 7 nötr, 7-14 arası baziktir. Mide öz suyu pH1−2 çok asidik, sabun pH9−10 baziktir, kan (pH 7,4) ise hafif baziktir.
Tuzlar, asitlerle bazların tepkimesinden oluşan iyonik bileşiklerdir. Sodyum klorür (NaCl), sodyum sülfat (Na₂SO₄), sodyum karbonat (Na₂CO₃) yaygın tuzlardır. Tuzlar elektriği iletir, yüksek erime ve kaynama noktalarına sahiptir.
Nötrleşme tepkimeleri, asitlerle bazların birleşerek tuz ve su oluşturduğu tepkimelerdir: HCl + NaOH → NaCl + H₂O. Tam nötrleşmede asitten gelen H⁺ iyonlarının sayısı, bazdan gelen OH⁻ iyonlarının sayısına eşittir.