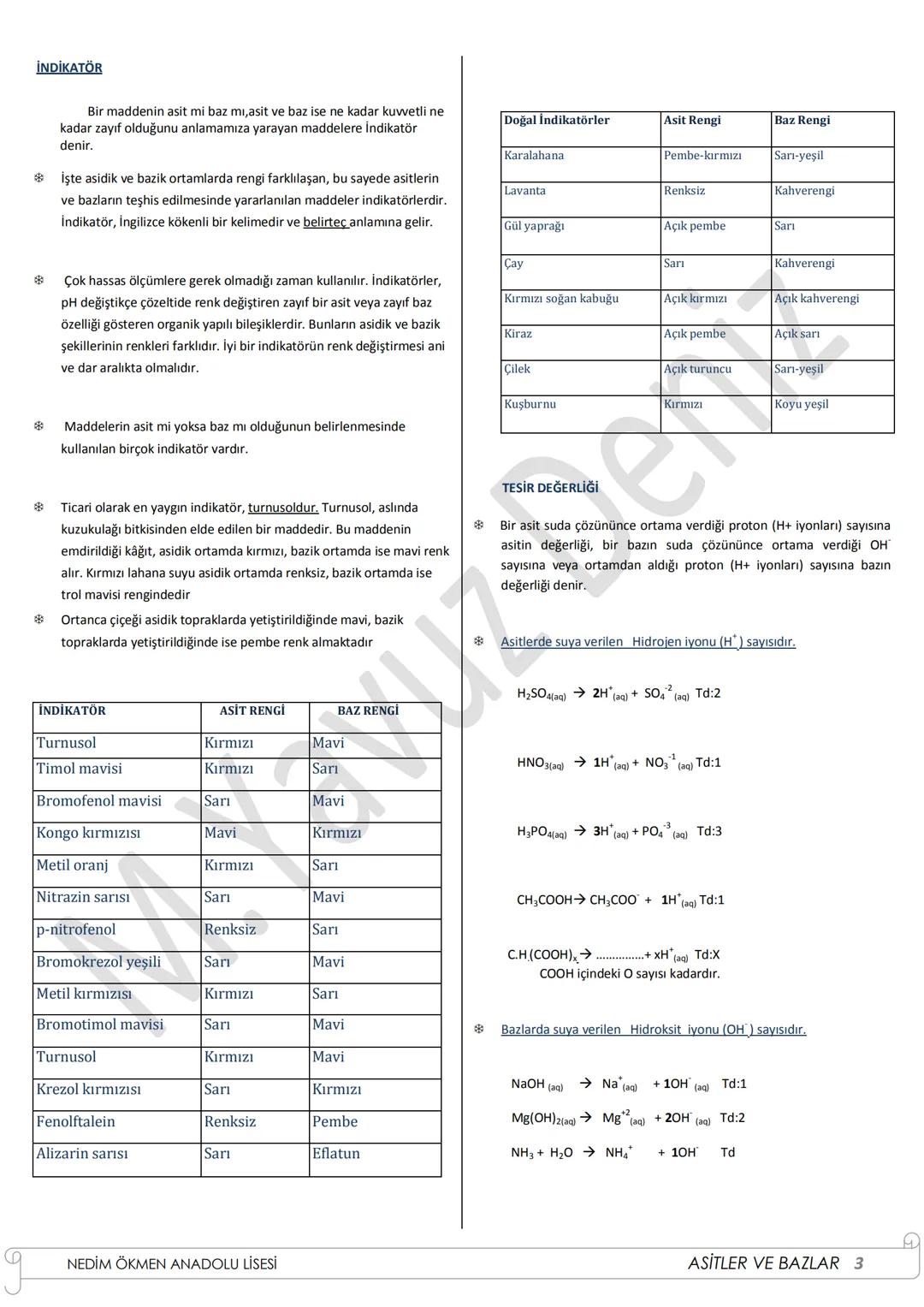
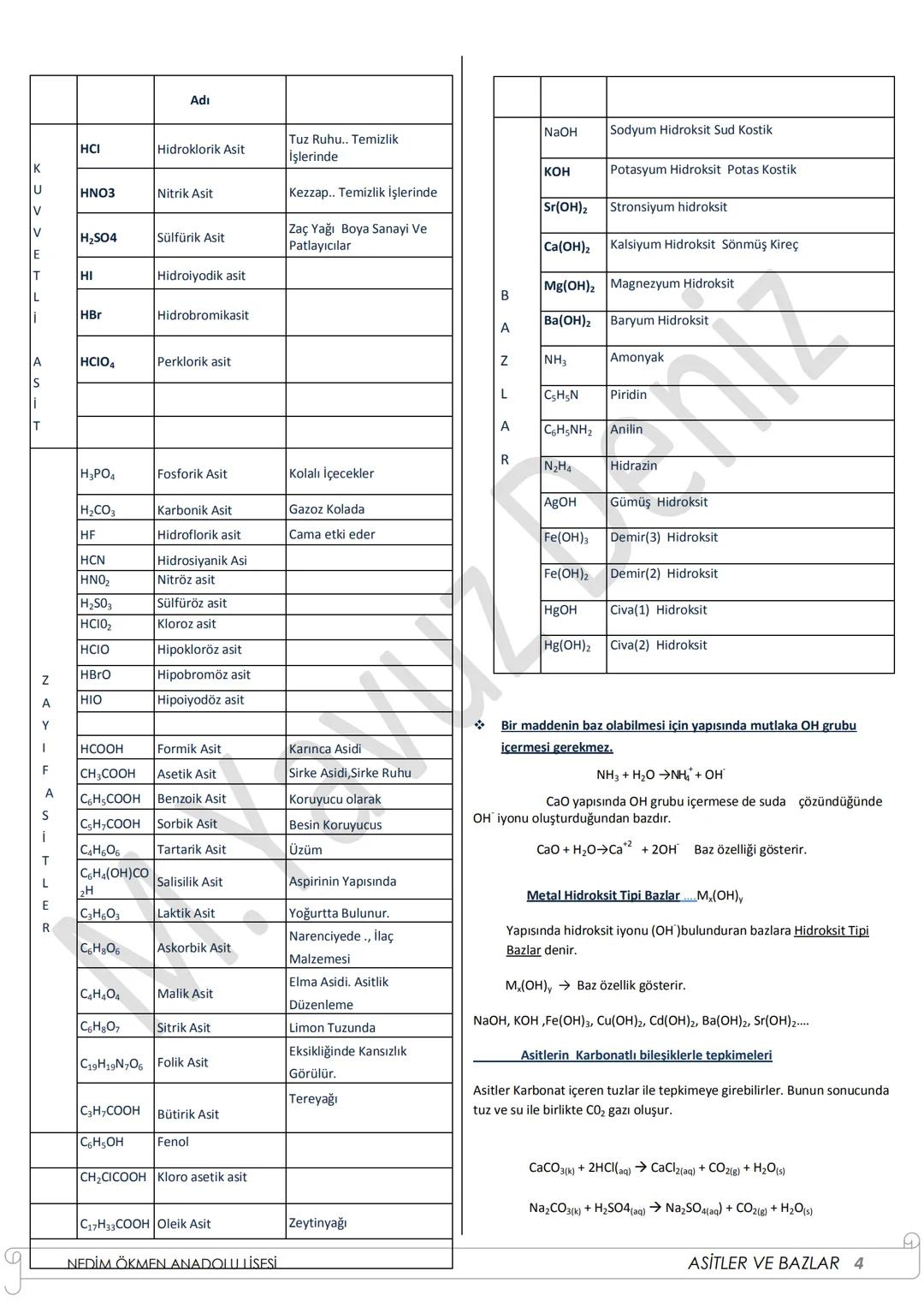
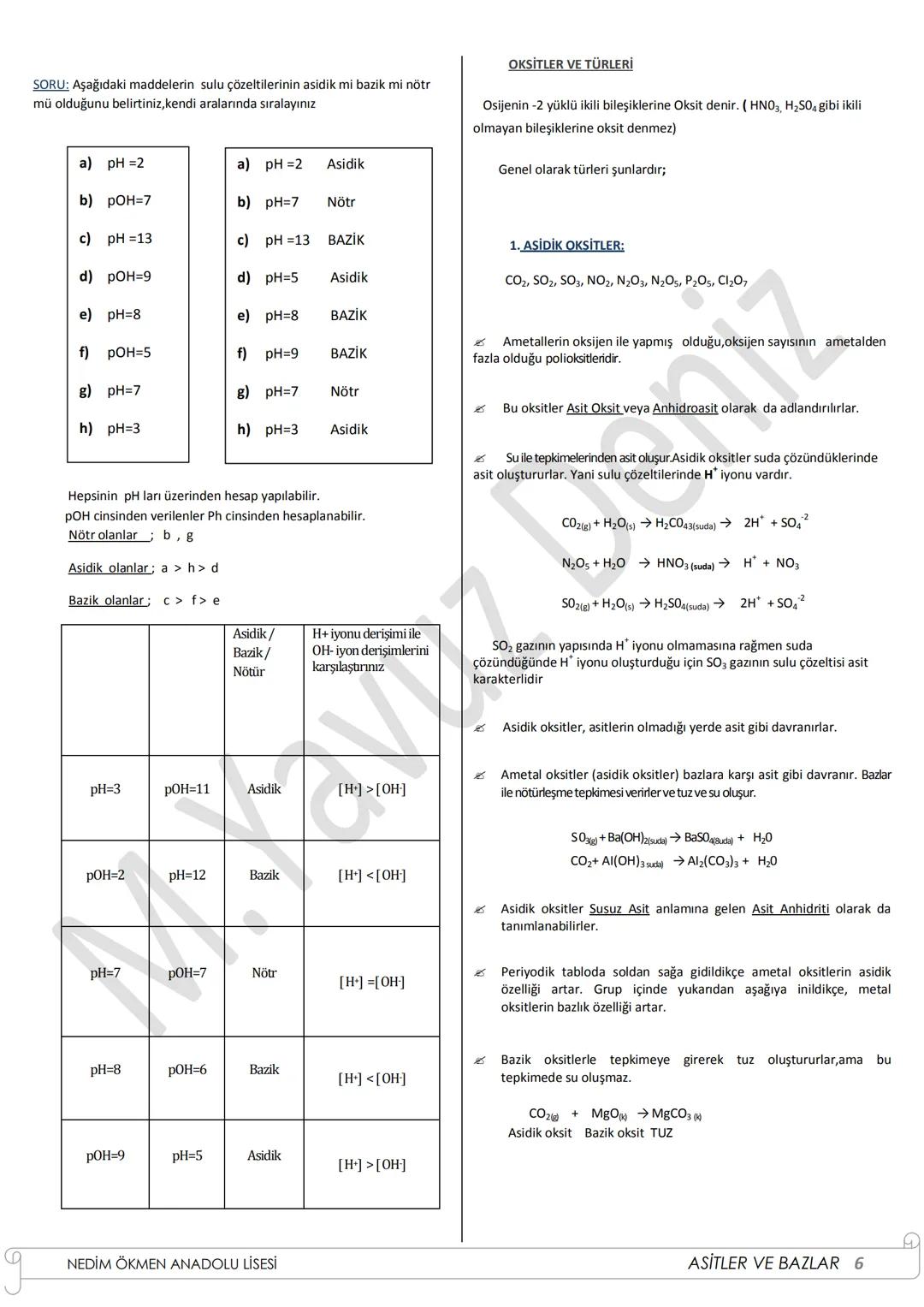
Oksitler ve Türleri
Oksijenin -2 yüklü ikili bileşiklerine oksit denir. Oksitler, asidik ve bazik özellik gösterebilirler.
1. Asidik Oksitler:
Genellikle ametallerin oksijen ile yaptığı bileşiklerdir. Örneğin:
- CO₂, SO₂, SO₃, NO₂, N₂O₃, N₂O₅, P₂O₅
Asidik oksitler su ile tepkimeye girerek asit oluştururlar:
$CO_{2(g)} + H_2O_{(s)} \rightarrow H_2CO_{3(suda)} \rightarrow 2H^+ + CO_3^{-2}$
$SO_{3(g)} + H_2O_{(s)} \rightarrow H_2SO_{4(suda)} \rightarrow 2H^+ + SO_4^{-2}$
Asidik oksitler, bazlarla tepkimeye girerek tuz ve su oluştururlar:
$SO_{3(gaz)} + Ba(OH)_{2(suda)} \rightarrow BaSO_{4(suda)} + H_2O$
$CO_2 + Al(OH)_{3(suda)} \rightarrow Al_2(CO_3)_3 + H_2O$
Asidik oksitler, bazik oksitlerle de tepkimeye girerek tuz oluştururlar (ancak su oluşmaz):
$CO_{2(gaz)} + MgO_{(katı)} \rightarrow MgCO_{3(katı)}$
Önemli: Periyodik tabloda soldan sağa gidildikçe ametal oksitlerin asidik özelliği artar. Grup içinde yukarıdan aşağıya inildikçe metal oksitlerin bazik özelliği artar.
pH ve pOH değerleri, bir çözeltinin asidik veya bazik olduğunu gösterir:
- pH < 7: Asidik çözelti ([H⁺] > [OH⁻])
- pH = 7: Nötr çözelti [H+]=[OH−]
- pH > 7: Bazik çözelti ([H⁺] < [OH⁻])