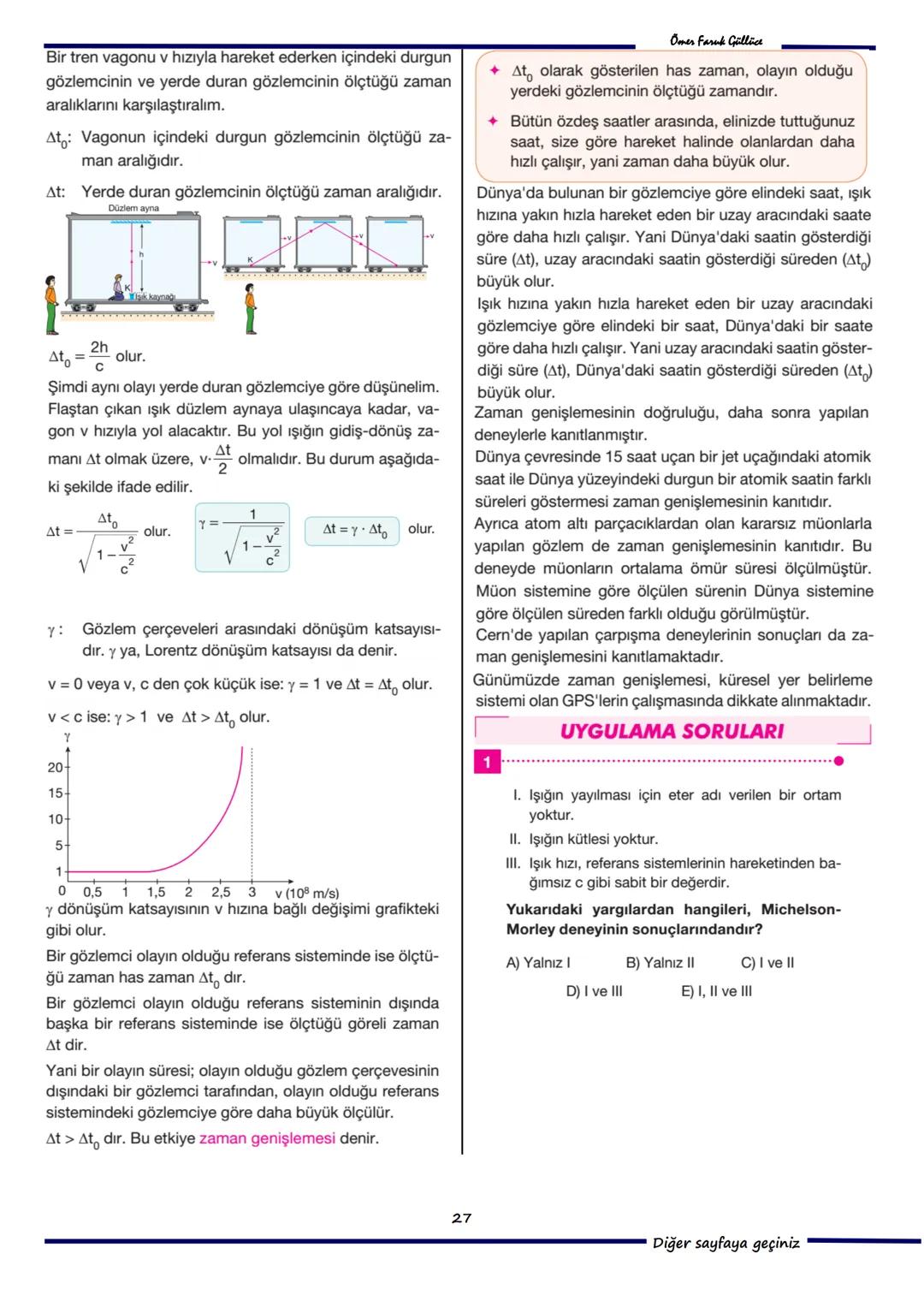
Sorular ve Problemler
Modern fizik ve atom modelleri hakkında öğrendiğin bilgileri pekiştirmek için aşağıdaki soruları çözmeye çalış. Her soru, farklı bir atom modelinin temel kavramlarını test ediyor.
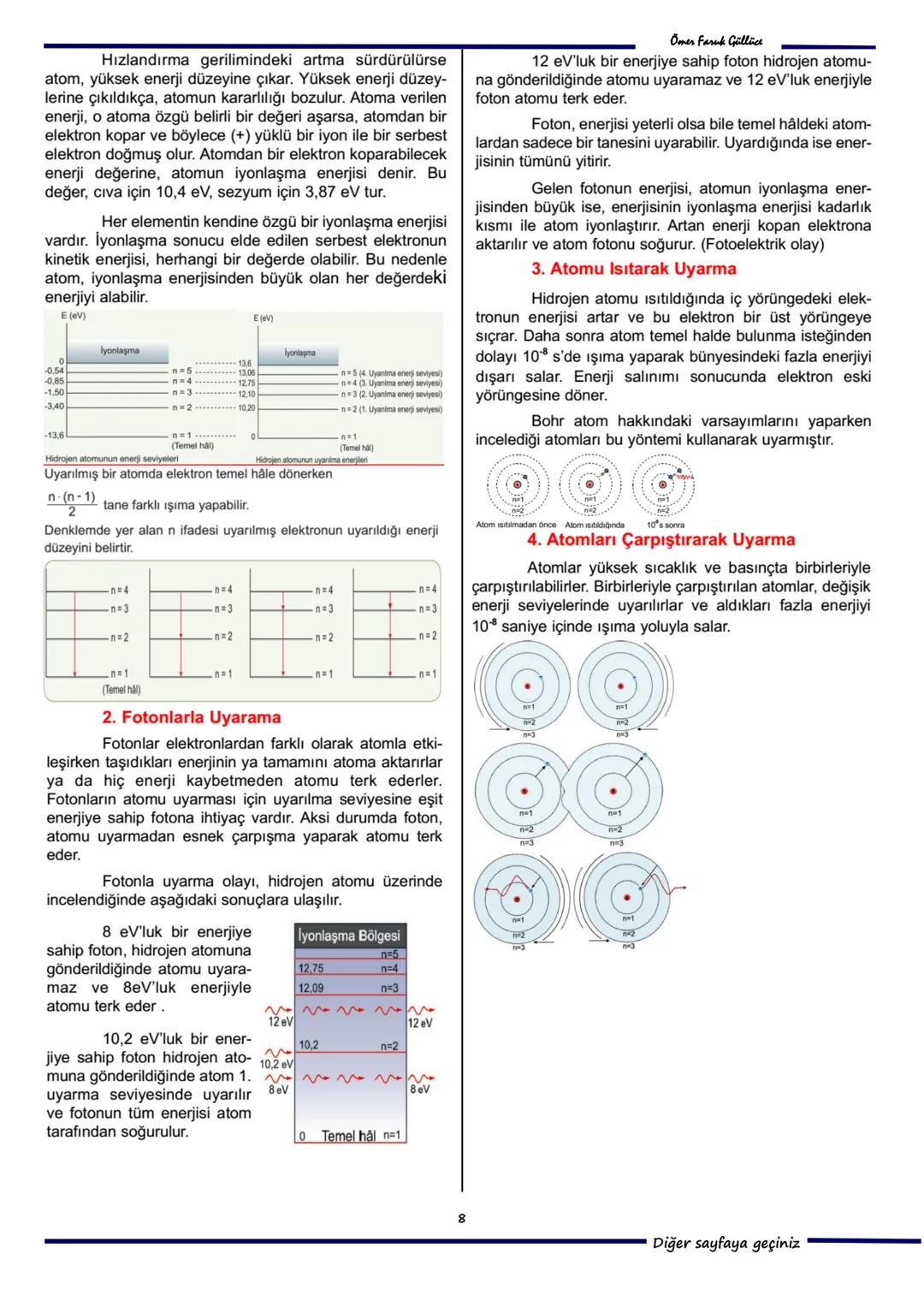
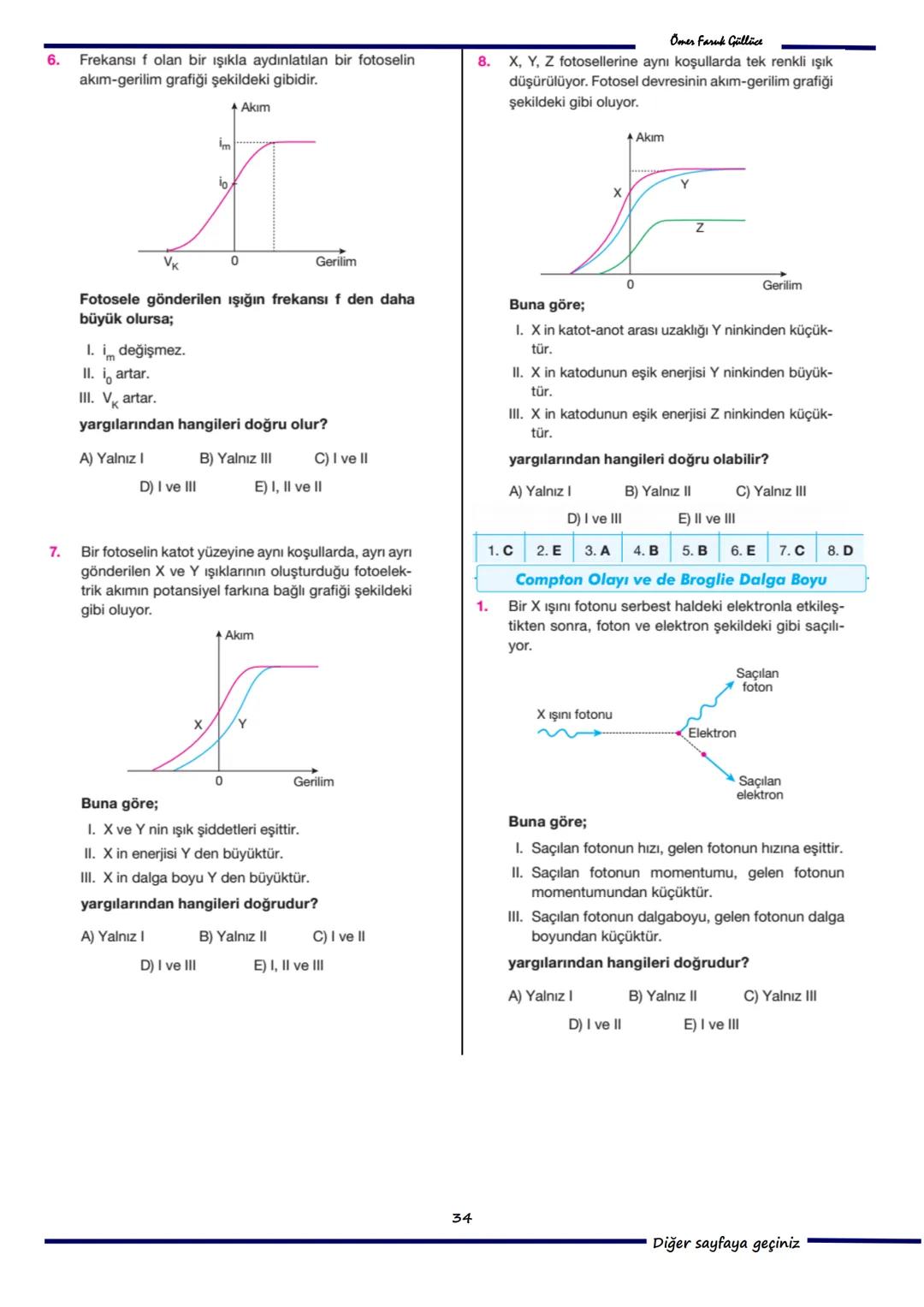
7. Soru: Bohr Atom Modeli'ne göre, hidrojen atomunda elektron çekirdekten uzaklaşan bir yörüngeye geçtiğinde açısal momentumu artar. Bu durumda açısal hızı azalır (II yanlıştır) ve toplam enerjisi artar (III yanlıştır). Doğru cevap A) Yalnız I'dir.
8. Soru: Bohr Atom Modeli, spektrum çizgilerinin parlaklık farkını açıklayamaz. Elektronun en küçük açısal momentum değeri ise sıfır değil, h/2π'dir. Doğru cevap D) II ve III'tür.
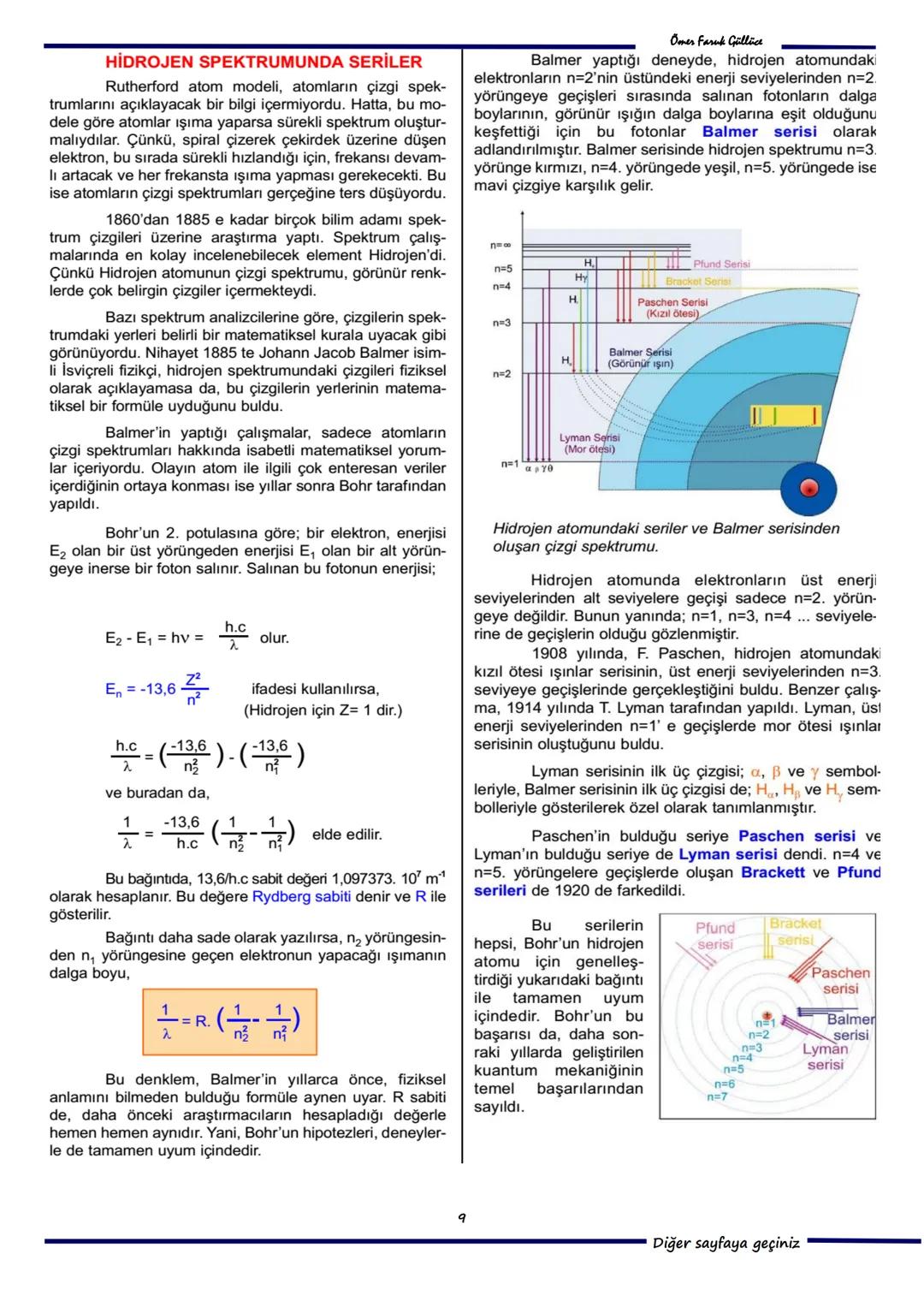
9. Soru: Sezyum atomunda enerji seviyeleri incelendiğinde, 1 eV enerjili bir elektronun atomu uyaramayacağını n=2′yec\cıkarmakic\cinenaz1,38eVgerekli, 2 eV enerjili bir elektronun atomu uyarabileceğini (1,38 eV'luk geçiş yapabilir) ve 3 eV enerjili bir fotonun atomu uyaramayacağını (fotonun enerjisi uyarılma seviyesine tam olarak eşit değil) görüyoruz. Doğru cevap B) Yalnız II'dir.
Püf Noktası: Elektronlarla uyarmada, elektronun enerjisi uyarılma seviyelerinden büyük olabilir, kalan enerji elektronda kalır. Ancak fotonlarla uyarmada, fotonun enerjisi uyarılma seviyesine tam olarak eşit olmalıdır!
10. Soru: Atomun enerji düzeyleri 1,5 eV, 2,4 eV ve 3,9 eV olan bir atomu X (1,4 eV), Y (3 eV) ve Z (4,2 eV) elektronlarıyla bombardıman ediyoruz. X elektronu atomu uyaramaz çünkü enerjisi en düşük uyarılma seviyesinden (1,5 eV) düşüktür. Y elektronu 1,5 eV'luk bir geçiş yapabilir, kalan 1,5 eV ise elektronda kalır. Z elektronu ise atomu iyonlaştırabilir. Doğru cevap D) Y ve Z'dir.
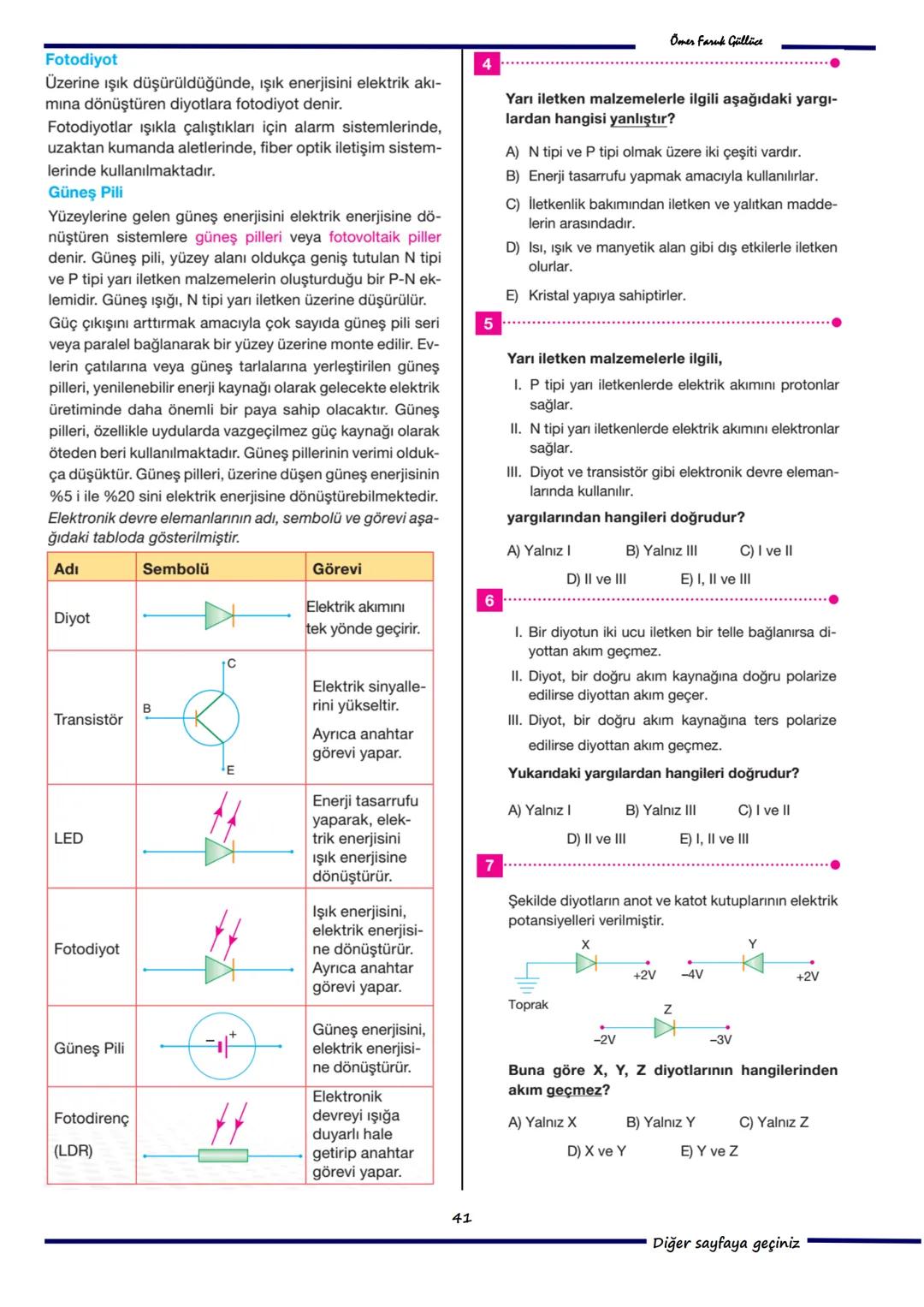
11. Soru: Sezyum atomuna 8,10 eV enerjili elektron gönderildiğinde, bu elektron bir atomu iyonlaştırıp (3,87 eV) başka bir atomu uyarabilir (örneğin 1,38 eV ve 2,30 eV). 8,10 eV enerjili bir elektron en fazla 2 atomu iyonlaştıramaz 3,87+3,87=7,74eV ve 5 atomu uyaramaz çünkü enerji yetmez. Doğru cevap C) Yalnız III'tür.
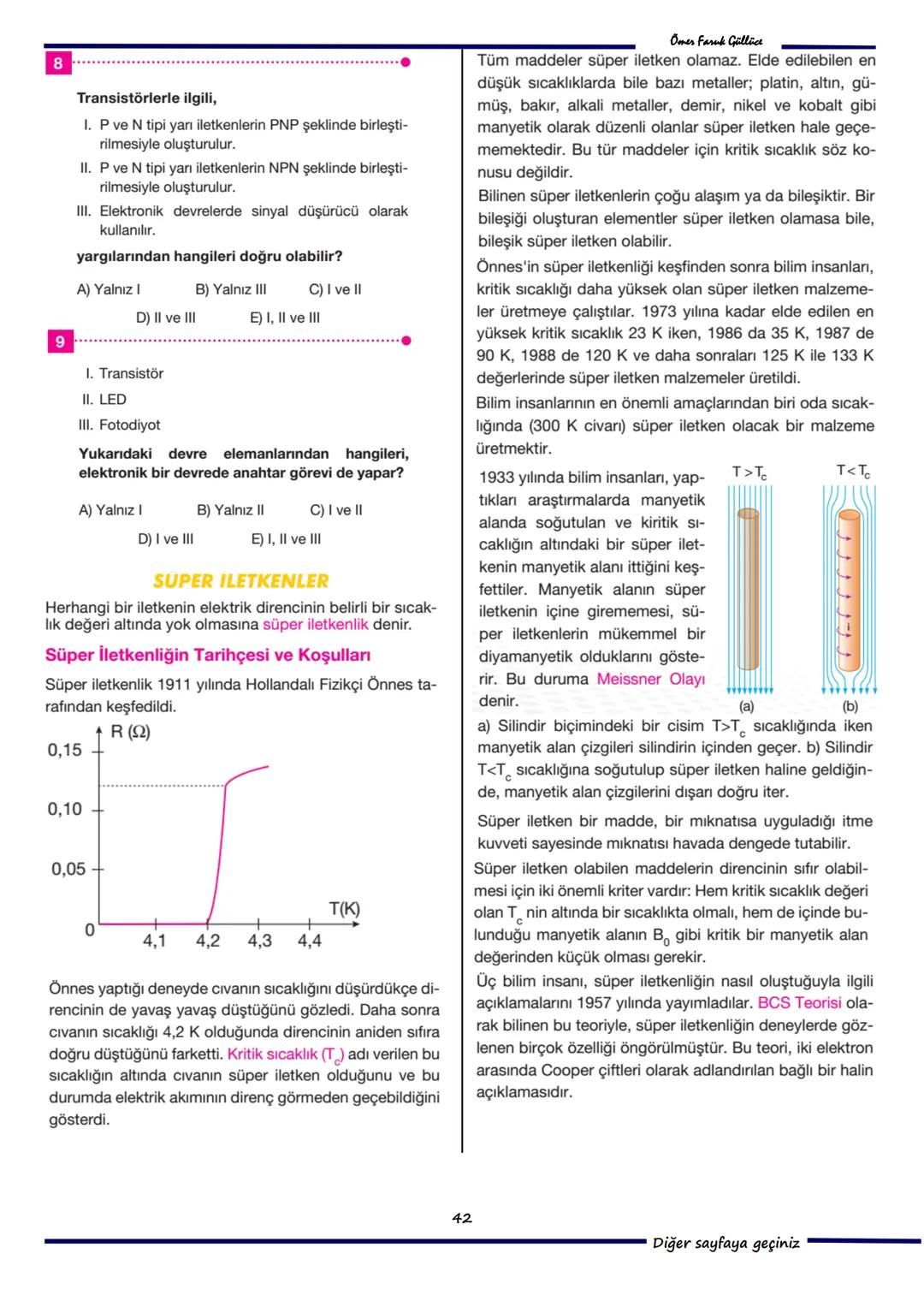
Bu sorular, atom modellerinin temel prensiplerini ve atomların enerji seviyelerini anlamanı sağlar. Elektronların ve fotonların atomlarla etkileşimini anlamak, modern fiziğin ve kuantum mekaniğinin temelini oluşturur.